06 Mai Des acteurs inattendus dans l’insuffisance hépatique aigüe orientent vers un traitement potentiel
Des microbes et des cellules hôtes de l’intestin s’unissent pour faire progresser cette maladie généralement incurable
L’insuffisance hépatique aigüe est une maladie dévastatrice qui progresse rapidement et entraîne la mort dans 80% des cas si aucune transplantation de foie n’est effectuée. Dans les pays développés, sa cause principale est une overdose de médicaments, plus précisément d’acétaminophène aussi connu sous le nom de paracétamol.
Dans une étude publiée dans Nature Medicine, des chercheurs du laboratoire des professeurs Eran Elinav et Ido Amit, du département d’immunologie de l’Institut Weizmann des Sciences, ont découvert chez des souris atteintes d’insuffisance hépatique aigüe, trois nouveaux sous-types de cellules hépatiques qui orchestrent le développement de cette maladie. Les scientifiques ont également découvert que des signaux – émis par le microbiome des intestins et par le foie malade – activent conjointement ces cellules et ils ont montré que bloquer ces signaux et appauvrir le microbiome entraînait une amélioration de la fonction hépatique et prolongeait la survie des souris. Une analyse de tissus hépatiques de patients humains souffrant d’insuffisance hépatique aigüe a révélé un modèle moléculaire ressemblant de façon frappante à celui des souris étudiées, permettant d’espérer que ces découvertes chez les souris pourraient être utilisées pour un traitement des humains.
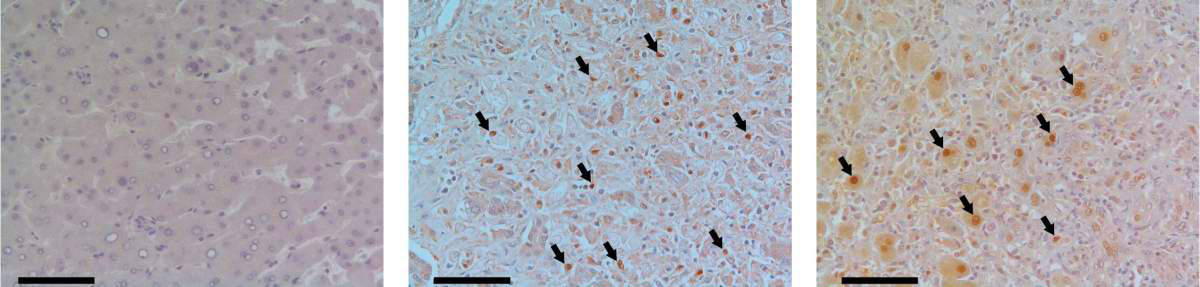
Tissu hépatique humain vu au microscope. Les échantillons de tissus de patients atteints d’insuffisance rénale aigüe (au centre et à droite) comparés à celui de donneurs sains (à gauche), présentent une augmentation significative des niveaux de la protéine MYC (en marron) dans le noyau des cellules (exemples indiqués par des flèches)
Le docteur Aleksandra Kolodziejczyk, en postdoctorat dans le laboratoire du professeur Elinav, dirige ce projet en collaboration avec d’autres scientifiques de l’Institut Weizmann des Sciences et le docteur Amir Shlomai de l’Institut pour le foie du Rabin Medical Center.
Le docteur Kolodziejczyk et ses collègues ont commencé leurs recherches en créant le profil d’expression génique de 45 000 cellules hépatiques de souris pour constituer un atlas complet des cellules hépatiques chez des individus en bonne santé et d’autres atteints d’insuffisance hépatique aigüe. Les scientifiques ont identifié 49 sous-types cellulaires, dont trois nouveaux – parmi les cellules stellaires, les cellules endothéliales et les cellules de Kupffer – devenaient particulièrement actifs au fil de la progression de l’insuffisance hépatique aigüe chez la souris. Ces sous-types jusqu’ici inconnus sécrètent une grande variété de substances qui attirent les cellules immunitaires de l’extérieur du foie et contribuent à l’endommager. Ces trois nouveaux sous-types cellulaires partagent un chemin d’expression caractéristique de 77 gènes – chemin contrôlé par la même protéine de régulation, le facteur de transcription MYC – qui indique que ces cellules pourraient être activées suivant un programme commun.
Les chercheurs pensent que ce nouveau chemin d’activation pourrait être régulé par des signaux venant du microbiome de l’intestin. Cette hypothèse est anatomiquement sensée car le tractus gastro-intestinal s’écoule dans le foie via un large réseau de veines, exposant directement le foie aux substances produites dans l’intestin par ses microbes. Quand les scientifiques ont affaibli le microbiome des souris en leur administrant des antibiotiques à large spectre, les symptômes d’insuffisance hépatique aigüe se sont atténués. De plus, quand ils ont provoqué une insuffisance hépatique aigüe chez des souris sans microbes et donc sans microbiome, la maladie est apparue bien moins sévère que chez des souris normales. Des études plus approfondies chez les souris avec ou sans microbiome intestinal ont révélé qu’au cours d’une insuffisance hépatique aigüe, des molécules particulières produites par le microbiome s’accumulent dans le foie où elles activent la protéine MYC dans les trois sous-types de cellules hépatiques qui contribuent à endommager le foie. En l’absence de microbiome, l’activation de la MYC est atténuée et donc les dommages au foie également.
Le docteur Kolodziejczyk a ensuite étudié les détails moléculaires de l’activation de la protéine MYC. Elle a découvert que les molécules venant du microbiome activent le programme MYC grâce à des récepteurs de surface situés sur les trois sous-types cellulaires identifiés dans ses recherches antérieures comme aggravant l’insuffisance hépatique. Elle a également découvert que le programme MYC était également activé – grâce aux mêmes récepteurs présents sur ces trois sous-types cellulaires – par les signaux venant de cellules hépatiques endommagées par du paracétamol.
Quand les souris étaient génétiquement dépourvues de récepteurs fonctionnels, ou avaient reçu des médicaments bloquant la protéine MYC ou encore en interrompant les signaux entre les récepteurs et la protéine MYC, elles ne développaient pas d’insuffisance hépatique aigüe et leur survie était prolongée. L’analyse de l’expression des gènes de cellules individuelles a montré que, chez les souris traitées, les trois sous-types identifiés précédemment n’étaient plus activés anormalement ce qui réduisait l’infiltration de cellules immunitaires et les dommages résultants sur le foie.
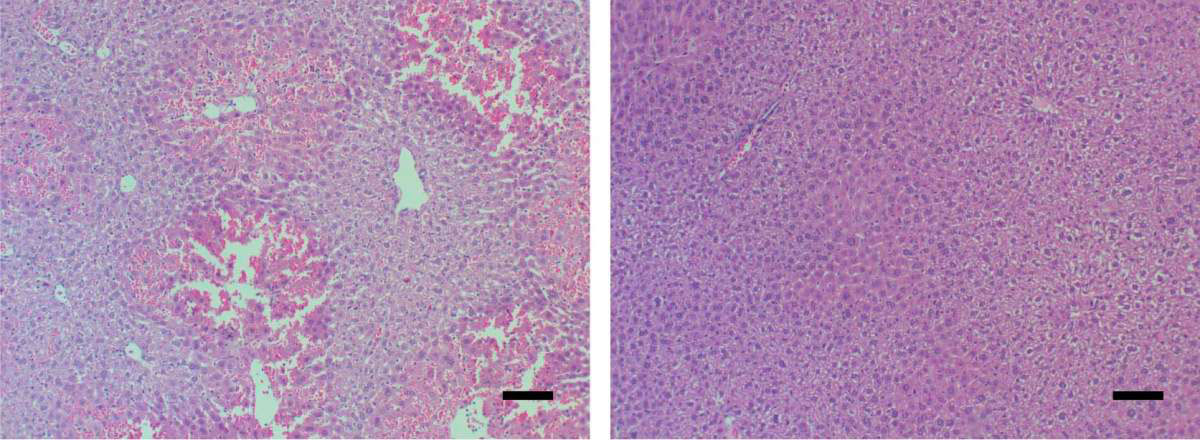
Tissus hépatiques de souris au microscope. Les signes d’insuffisance hépatique aigüe (à gauche) disparaissent chez les souris (à droite) lorsqu’elles ont reçu un médicament bloquant la protéine MYC
Finalement, les chercheurs se sont associés au docteur Shlomai pour analyser des échantillons de foie de patients souffrant d’insuffisance hépatique aigüe afin de les comparer avec des échantillons de donneurs de foie sains. Ceux des malades – contrairement à ceux des donneurs – étaient caractérisés par une activation importante de la protéine MYC similaire à celle observée chez les souris. Ces résultats suggèrent un traitement potentiel de l’insuffisance hépatique aigüe, par blocage du programme MYC par des médicaments, couplé à une modulation du microbiome.
« Nos découvertes sont la première étape vers la compréhension de l’interaction entre microbiome et hôte dans le cas de l’insuffisance hépatique aigüe, » dit le professeur Elinav. « De telles connaissances pourraient mener à des options de traitement pour cette maladie dévastatrice et incurable. »
D’autres chercheurs ont également participé à cette étude : le docteur Sara Federici, le docteur Ziv Zmora, le docteur Gayatree Mahapatra, le docteur Mally Dori-Bachash, Shanni Hornstein, le docteur Avner Leshem et le docteur Hagit Shapiro du laboratoire du professeur Elinav ainsi que le docteur Tomer Meir Salame de la faculté de l’Institut Weizmann des Sciences, le professeur Alon Harmelin du département de ressources vétérinaires de l’Institut Weizmann, le docteur Debby Reuveni et le docteur Ehud Zigmond du centre médical Tel-Aviv Sourasky et le docteur Ana Tobar du Rabin Medical Center.
Les recherches du professeur Ido Amit sont financées par la bourse pour les recherches innovantes Helen et Martin Kimmel, l’Institut Sagol pour la recherche sur la longévité, l’Institut pour la génétique médicale de la famille Kekst, la fondation de la famille Thompson pour la recherche sur Alzheimer, la fondation Adelis, Richard et Jacqui Scheinberg, la fondation Ben B. et Joyce E. Einsenberg, la fondation Anita James Rosen, la fondation Lowy, l’institution caritative de la famille Wolfson, la famille Vainboim, Lady Michelle Michels, Rosanne Cohen, Mauricio Gerson, Erika Mogyoros, Thomas Franklin Buccheim, Jeff Pinkner et Maya Iwanaga, la succession Simon Saretzky et la succession Arthur Rath. Le professeur Amit est détenteur de la chaire professorale Eden et Steven Romick.
Les recherches du professeur Eran Elinav sont financées par l’institut Morris Kahn pour l’immunologie, le fonds Pearl Welinsky Merlo pour la recherche sur le progrès scientifique, le fonds pour la recherche sur le cancer Hanna et docteur Ludwik Wallach, l’institution caritative Leona M. et Harry B. Helmsley, la fondation Adelis, la fondation de la famille Lawrence et Sandra Post, Yael et Rami Ungar, le fonds Daniel Morris, l’institution caritative Harold Altman, l’institution caritative Howard et Nancy Marks, le conseil européen pour la recherche, la fondation Ben B. et Joyce E. Eisenberg, la famille Vainboim, Alex Davidoff, la White Rose International Foundation et le centre pour la recherche sur les sciences de la vie Jeanne et Joseph Nissim. Le professeur Elinav est détenteur de la chaire professorale Marc et Lady Tania Feldmann.


