26 Jan Piocher dans la même Pile
Le secret de la régénération cardiaque dans le cas d’insuffisance cardiaque chronique démontrée chez les souris
Les maladies cardiaques et les insuffisances cardiaques chroniques affectent près de 10% des adultes de plus de 65 ans. Il n’existe toujours aucune façon de régénérer les tissus cardiaques durcis et remplacés par du tissu cicatriciel en excès, réduisant progressivement la capacité du cœur à pomper le sang du corps. Des chercheurs de l’Institut Weizmann des Sciences ont montré comment exactement, chez la souris, le cœur peut se régénérer en activant des cellules du tissu cardiaque non affecté– il suffit du bon déclencheur.

Professeur Eldad Tzahor et Alla Aharonov
Après la naissance, les cellules du muscle cardiaque humain – les cardiomyocytes – sont configurées pour la vie. Elles ne se divisent presque plus, ne se régénèrent pas et n’engagent aucune réparation quand elles sont endommagées. Lors d’une précédente étude, des scientifiques du laboratoire du professeur Eldad Tzahor du département de biologie cellulaire et moléculaire ont découvert que les souriceaux parvenaient à régénérer leur cœur en activant un récepteur à la surface des cardiomyocytes, appelé ERBB2, essentiel pour le développement du cœur embryonnaire. Quand les scientifiques ont activé ce récepteur sur les membranes de cardiomyocytes de souris adultes juste après une attaque cardiaque, ils ont découvert que leur cœur pouvait inverser les dommages. Dans une nouvelle étude, Alla Aharonov, étudiante en recherche dans le laboratoire du professeur Tzahor, a approfondi les recherches sur ce phénomène quasi miraculeux tout en se demandant si ce même récepteur pouvait être activé dans un état plus grave, lorsque le cœur présente déjà les changements structuraux caractéristiques de l’insuffisance cardiaque.
Les expériences ont été menées avec des souris transgéniques conçues pour surproduire de l’ERBB2 spécifiquement dans les cardiomyocytes. Leur conception comprenait également une « clef » pour activer ces récepteurs à la demande, permettant aux chercheurs de contrôler précisément le déclenchement du processus de régénération. Les souris subissaient une attaque cardiaque, les chercheurs laissaient la situation progresser jusqu’à une maladie cardiaque grave avant d’utiliser cette clef pour activer le récepteur ERBB2. Il se produisait ensuite quelque chose de remarquable : les cellules se divisaient et formaient un nouveau tissu cardiaque.
De plus amples recherches ont révélé qu’après avoir reçu les signaux d’ERBB2, les cardiomyocytes adultes revenaient à leur forme juvénile antérieure. Ces cellules « revenues en arrière » étaient donc capables de division mais pas uniquement : leur examen plus poussé a surpris les scientifiques, ces cellules étaient moins attachées à leurs voisines et avaient acquis la capacité de se déplacer, leur forme était différente et elles pouvaient même sécréter des enzymes supprimant les cicatrices. Ces aptitudes sont caractéristiques d’un processus appelé transition épithélio-mésenchymateuse (TEM), généralement observé lors du développement embryonnaire ou lors de la métastase d’un cancer mais jamais encore dans le cas de la régénération cardiaque.
Si les transformations extérieures des cellules sont spectaculaires, la métamorphose de leur architecture interne ou moléculaire l’est au moins autant. Elle commence par des altérations de la « charpente » structurale des cellules – le cytosquelette. Les changements du cytosquelette provoquent l’activation d’un processus cellulaire particulier, une chaine de réactions biochimiques, qui régule les effets d’ERBB2. Le point central de cet enchaînement est une protéine appelée YAP (Yes-associated protein) qui pousse fortement la croissance et la division cellulaire. Les cellules adultes, en particulier les cellules cardiaques qui sont destinées à vivre des années, possèdent toutes sortes de mécanismes afin d’empêcher son activation. Chez les souris transgéniques, le processus de l’ERBB2 est détourné – en utilisant le cytosquelette modifié pour passer outre ces inhibiteurs et activer fortement YAP.
D’autres expériences sur des souris dans lesquelles ERBB2 était surexprimé mais YAP était absente ont confirmé ce dispositif : YAP est nécessaire pour que les effets régénérateurs d’ERBB2 soient transmis. Après plusieurs semaines d’activation d’ERBB2 chez les souris possédant à la fois ERBB2 et YAP, les cœurs des souris ont retrouvé dans une large mesure leur capacité de pompage.
Cependant, ce type de mécanisme contient un avertissement, pour la suppression des cicatrices, il utilise les mêmes stratagèmes que celui des cellules cancéreuses pour envahir le tissu qui les entoure. Le professeur Tzahor dit : « Puisqu’ERBB2 et YAP sont associées au cancer, nous devons nous assurer que nous pouvons interrompre ce processus rapidement. En fait, nous avons provoqué une sorte de « mini cancer » dans le cœur, notre capacité de contrôle du déclenchement de ces signaux est donc primordiale. Quand nous avons stoppé ce signal, les cellules ont de nouveau atteint un stade adulte, ne pouvant plus se diviser. »
« En réalité, les mécanismes de division et de croissance cellulaire sont très proches que ce soit pour le développement d’un embryon, la réparation d’une blessure ou le développement d’un cancer, » dit Alla Aharonov. « Ils viennent tous « de la même pile ». Néanmoins, la connexion ERBB2-cytosquelette-YAP suggère que le corps mélange un peu les cartes. C’est pourquoi un même processus peut être impliqué dans un cancer d’une part, mais employé de façon éphémère, il peut aussi réparer le cœur. Observer la régénération cardiaque à travers le prisme de la TEM met en évidence le fait que la régénération nécessite l’enchaînement de plusieurs évènements afin de traiter un cœur au bord de l’insuffisance. »
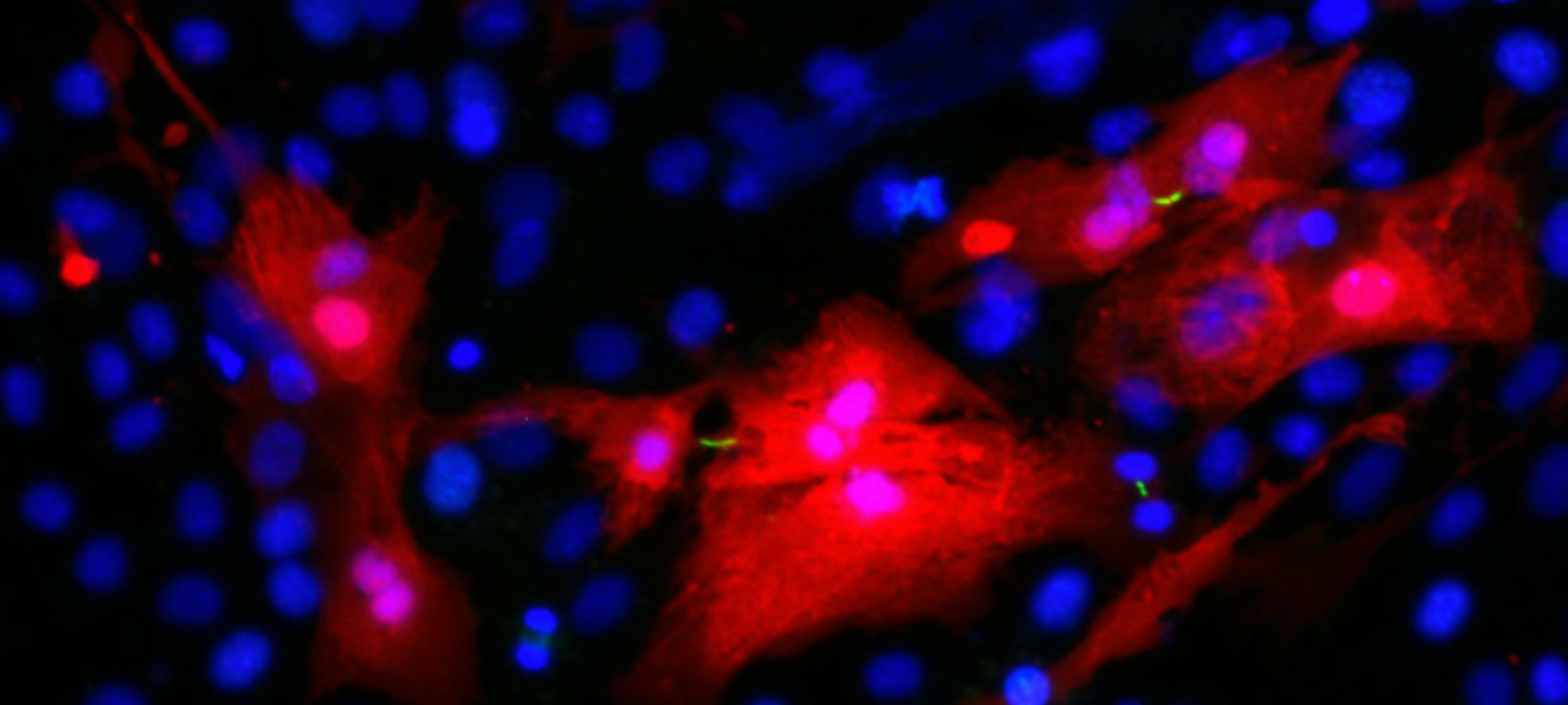
Culture cardiaque. Les cardiomyocytes sont en rouge ; les lignes vertes sont les sillons de division entre les cellules
« Cette étude montre quelque chose que l’on a longtemps considéré comme impossible : la réversibilité de l’insuffisance cardiaque et la capacité des cellules cardiaques à en détenir la clef si on leur donne un petit coup de pouce, » ajoute le professeur Tzahor.
D’autres chercheurs ont participé à cette étude : Avraham Shakked, le docteur Kfir Baruch Umansky, le docteur Or-Yam Revach, Alexander Genzelinakh, le docteur David Kain, le docteur Daria Lendengolts et le professeur Benjamin Geiger du département de Biologie Moléculaire et Cellulaire, le docteur Alon Savidor et le docteur Yishai Levin du Centre national israélien pour la médecine spécialisée Nancy et Stephen Grand, Yuka Morikawa du Texas Heart Institute, à Houston, Texas, le professeur Jixin Dong du centre médical de l’Université du Nebraska, à Omaha et le professeur James F. Martin du Baylor College of Medicine et du Texas Heart Institute.
Le professeur Eldad Tzahor dirige le Centre de recherche Yad Abraham pour le diagnostic et la thérapie du cancer. Ses recherches sont également financées par le Zuckerman STEM Leadership Programm, Israel Englander, le fonds de dotation du docteur Dvora et de Haim Teitelbaum et Pearl C. Vapnek.


