27 Nov À la Recherche d’une Forte Inhibition
Une méthode unique d’identification de composés chimiques bioactifs produit une nouvelle molécule médicamenteuse prometteuse.
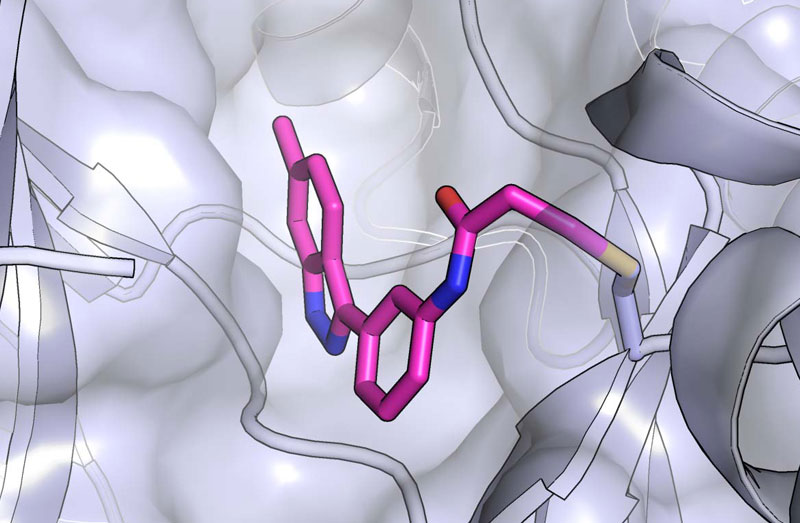 La cristallographie aux rayons X confirme la liaison covalente d’un nouvel inhibiteur (magenta) avec la MKK7 (gris)
La cristallographie aux rayons X confirme la liaison covalente d’un nouvel inhibiteur (magenta) avec la MKK7 (gris)
Nos cellules reçoivent plus de messages que le téléphone d’un adolescent et, comme avec les écrans, nous avons parfois besoin de filtrer les messages néfastes – de préférence avant qu’ils ne soient lus. Le docteur Nir London et son équipe du Département de Chimie Organique de l’Institut Weizmann des Sciences utilisent de nouvelles méthodes de calcul pour identifier une molécule qui leur permettrait d’arrêter les messages néfastes dans la cellule – avant qu’ils ne soient « lus » par le noyau des cellules et sans qu’ils n’interfèrent avec les autres messages nécessaires au fonctionnement cellulaire. Les découvertes de cette étude ont récemment été publiées dans Cell – Chemical Biology.
Une fois qu’un signal pénètre dans une cellule après avoir traversé sa surface externe, l’information est relayée jusqu’à son noyau par une série de protéines faisant partie d’une des voies de signalisation des cellules. Les signaux en question sont principalement ceux qui contrôlent l’ensemble des fonctions biologiques mais ils jouent aussi un rôle dans le cas de certaines maladies – de l’inflammation aux maladies auto-immunes ou métaboliques jusqu’aux signaux erronés de croissance dans le cas des cancers. Ainsi ces voies de signalisation sont des cibles parfaites pour les médicaments. Par exemple la voie étudiée par le docteur London et son équipe, voie connue par ses initiales JNK, régule la mort cellulaire qui suit l’accumulation de plaques dans le cerveau dans le cas de la maladie d’Alzheimer et joue aussi un rôle dans l’inflammation.
Les liens « parfaits »
Les molécules de signalisation de cette voie – des protéines appelées kinases – transmettent leurs messages grâce à des interactions chimiques : chacune attache un groupe phosphoré à la kinase suivante de la chaîne. L’extrémité « amont » de la chaîne peut comprendre un groupe de kinases appelées MAP3Ks. Le lien suivant n’est composé que de deux kinases – MKK4 et MKK7 – qui transmettent le signal au lien final – la protéine JNK qui donne son nom à la voie de signalisation – Ce lien final transmet le message aux facteurs de transcription qui activent et désactivent certains gènes dans le noyau.
« C’est la façon dont de nombreuses voies de signalisation sont construites, se réduisant à deux kinases puis à un goulot d’étranglement à la dernière étape, » dit le docteur London. « Nous avons utilisé cette caractéristique pour trouver le meilleur endroit pour interférer avec le signal. On trouve entre cinq et dix MAP3Ks en début de chaîne, et comme il y a redondance, il faudrait toutes les bloquer.La protéine JNK en fin de la chaîne effectue de nombreuses fonctions dans toutes les cellules du corps, donc cibler cette kinase pourrait créer de sérieux effets secondaires. Nous pensons que les MKKs sont les liens parfaits dans la chaîne. En cibler une seule pourrait réduire les messages néfastes sans complètement bloquer la voie de signalisation»
Les chercheurs se sont concentrés sur l’une des deux MKKs – la MKK7 – une kinase qui n’a pas d’inhibiteurs connus et qui n’est pas entièrement comprise, en partie parce qu’il n’y avait aucun moyen jusqu’à aujourd’hui de séparer ses actions de celle de sa protéine sœur, la MKK4. Ils ont découvert, pour leur plus grande satisfaction, un acide aminé appelé cystéine, situé sur la MKK7 à un endroit inhabituel pour les cystéines des kinases. Les cystéines sont connues pour former des liaisons chimiques fortes et irréversibles (en termes de chimie elles sont dites « covalentes »). Ainsi, une molécule qui se lierait spécifiquement à ce site particulier et formerait une liaison stable avec cette cystéine pourrait être hautement sélective et ne produire que peu d’effet secondaires.

(de gauche à droite) Le docteur Nir London et Amit Shraga
Le docteur London avait précédemment développé une méthode informatique permettant de découvrir des composants biologiquement actifs dans l’inhibition des protéines. Il peut en fait simuler in silico les méthodes actuelles de criblage à haut débit – qui nécessitent une importante installation robotique et des composants réels – et « tester » ainsi l’efficacité de plus de 100.000 molécules à la fois. Cette méthode permet même à ses utilisateurs d’évaluer des molécules qui n’existent pas encore.
Dans cette étude, l’étudiant chercheur Amit Shraga et d’autres membres de l’équipe du docteur London ont travaillé avec l’équipe du docteur Ziv Shulman du Département d’Immunologie de l’Institut, avec les docteurs Bruce Lefker et Chakrapani Subramanyam, avec des scientifiques de Pfizer Recherche et Développement (USA), avec leurs collègues du Centre National israélien pour la Médecine Personnalisée Nancy et Stephen Grand, avec le professeur Takayoshi de l’Université Préfectorale d’Osaka (Japon) et avec le docteur Robert Hudkins de Teva Pharmaceuticals, Inc.
Après avoir identifié par ordinateur une dizaine de composants prometteurs, l’étape suivante était de les tester en laboratoire ; trois d’entre-eux ont bien fonctionné et l’un d’eux s’est particulièrement bien lié à la kinase. L’équipe de recherche a ensuite examiné le « modèle d’amarrage » produit par le logiciel, afin de comprendre la façon dont ce composant efficace se lie à la cystéine. Les chercheurs ont ensuite créé des variations de ce composant pour voir s’il était possible de le perfectionner encore.
Dans les expériences en laboratoire, quand on empêchait la molécule de ce composant de former la liaison covalente avec la cystéine, il n’y avait pas d’inhibition – prouvant ainsi que cette liaison était bien responsable de l’interruption du signal. Les chercheurs ont alors introduit cette molécule dans des cellules immunitaires de souris qu’ils ont exposées à une substance connue pour déclencher la voie JNK. Là aussi, ils ont observé que la molécule était très efficace dans la prévention de la réponse inflammatoire des cellules.
Résolution atomique
Enfin, en collaboration avec le laboratoire japonais, l’équipe a cristallisé le complexe formé entre la molécule et sa kinase cible et a déterminé leur structure – un processus comparable à une photographie de l’interaction à l’échelle atomique. Ils ont découvert que la structure de la liaison suivait exactement le modèle informatique. Quand le composant a été testé en laboratoire sur 76 kinases distinctes, seules deux ou trois ont réagi d’une façon significative. C’était une preuve de plus que les effets secondaires d’un médicament basé sur cette molécule seraient relativement limités, voire inexistants.
La molécule que le docteur London et son équipe ont ainsi identifiée pourrait avoir des applications thérapeutiques en prévenant la mort cellulaire non désirée dans le cas de maladies comme Alzheimer ou en réduisant l’inflammation dans le cas de troubles comme le côlon irritable ou le diabète. « Puisque la molécule se lie de façon covalente à la kinase, elle continue d’inhiber cette protéine pour toute sa durée de vie. Cela signifie que si la molécule passe les essais cliniques – qui sont encore bien loin – elle pourrait être administrée à petite dose ou ponctuellement, » dit le docteur London. YEDA Recherche et Développement, le pôle transfert technologique de l’Institut Weizmann des Sciences, a déposé un brevet sur cette molécule.
« Maintenant que nous avons un inhibiteur de MKK7, nous pouvons commencer à étudier les fonctions séparées des deux protéines intermédiaires qui transmettent les messages par cette voie » dit Amit Shraga. « Cela nous aidera finalement à découvrir comment laisser les signaux voyager correctement sur cette voie de signalisation sans transmettre le moindre message non désiré. »
Les recherches du docteur Nir London sont financées par le Centre pour la Conception Moléculaire Helen et Martin Kimmel, la Fondation Rising Tide, le Fond pour la Recherche sur le Cancer Joel et Mady Dukler et Virgin JustGiving. Le docteur London est titulaire de la Chaire pour le Développement de Carrière Alan et Laraine Fischer.


