15 Juin Des scientifiques identifient une protéine clef régénérant le tissu cardiaque
Les maladies cardiaques demeurent la principale cause de décès dans le monde. Dans certains cas, des traitements existants protègent les tissus cardiaques des dommages. Mais une fois que les dégâts ont eu lieu, ils sont irréversibles. Actuellement, une nouvelle étude de l’Institut Weizmann des Sciences montre qu’une molécule présente dans le cœur des nouveau-nés semble contrôler le processus de réparation et de régénération suite à une lésion.
L’étude, publiée récemment dans Nature et conduite par le Professeur Eldad Tzahor du Département de Biologie Moléculaire et Cellulaire, a identifié qu’une molécule, appelée Agrin, qui est active durant le développement embryonnaire puis disparaît peu après la naissance. Quand on l’introduit dans un cœur de souris adulte, l’Agrin semble « débloquer » le processus de régénération qui permet la réparation des muscles du cœur.
Après une attaque cardiaque, le cœur d’un adulte commence à guérir, lentement et en laissant des cicatrices indésirables. Le tissu cicatriciel est en effet incapable de se contracter et ne peut donc pas pomper le sang, induisant un stress sur l’ensemble du cœur – ce qui conduit à un arrêt cardiaque. C’est ce qui se passe chez les humains. Les poissons, eux, peuvent régénérer efficacement leur cœur quand il est endommagé et les souris conservent cette capacité jusqu’à une semaine après leur naissance, donnant au Professeur Tzahor une fenêtre d’étude lui permettant d’explorer les clefs de la régénération cardiaque.
Dans le laboratoire du Professeur Tzahor, l’étudiant en doctorat Elad Bassat était le moteur de ce projet ; il était aidé par d’autres membres de l’équipe, en collaboration avec d’autres institutions. Les chercheurs soupçonnaient le tissu de soutien entourant les cellules cardiaques – connu sous le nom de matrice extracellulaire (MEC) – de contenir le secret de la régénération tissulaire des cœurs embryonnaires puisque de nombreux messages entre les cellules passent par cette matrice tandis que d’autres y sont même stockés. Ils ont découvert qu’une MEC plus jeune favorisait la prolifération de cellules musculaires cardiaques appelées cardiomyocytes. Quand les scientifiques ont filtré les protéines de la MEC pour isoler celles causant cette prolifération, ils ont identifié l’Agrin comme acteur clef du renouvellement du tissu cardiaque. L’Agrin était déjà connue pour son rôle dans la régulation des signaux entre nerfs et muscles.
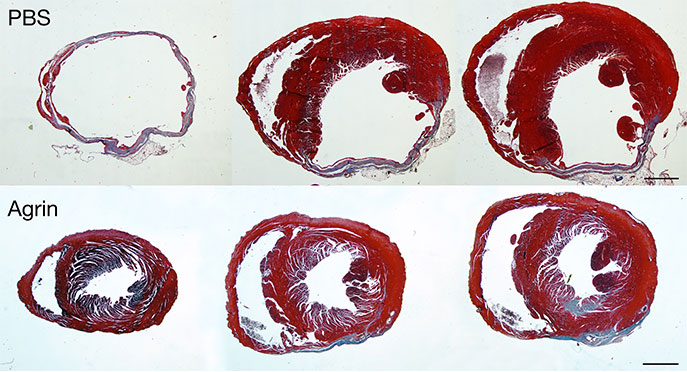
Quand ils ont introduit l’Agrin dans des cœurs de souris blessés, ceux-ci ont été presque entièrement guéris et sont redevenus pleinement fonctionnels après environ un mois. A la fin de la période de convalescence, le tissu cicatriciel avait considérablement diminué, remplacé par du tissu cardiaque actif, restaurant la fonction de pompage du cœur.
Remonter le temps
Il est apparu qu’en plus de susciter le renouvellement des cardiomyocytes, l’Agrin pouvait affecter les réponses inflammatoires et immunitaires du corps en réponse à une attaque cardiaque, affirme le Professeur Tzahor. De plus, la molécule pourrait avoir une influence sur les mécanismes de suppression du tissu cicatriciel.
« Cette molécule met clairement en route une succession d’événements », dit-il. Il apparaît que l’Agrin agit en se liant à un récepteur situé sur les cellules musculaires du cœur, qui renvoie les cellules à un stade plus jeune et favorise ainsi la division cellulaire des cardiomyocytes.
L’équipe de recherche a testé l’action de l’Agrin sur des cellules musculaires cardiaques humaines, et a commencé des essais précliniques en Allemagne en collaboration avec l’Université Technique de Munich, afin de déterminer les effets de l’Agrin sur la réparation cardiaque. Ces études pourraient mener à une thérapie des maladies cardiaques, et offrir ainsi une solution aux maladies cardiaques, qui sont aussi les plus mortelles aujourd’hui dans le monde.
Les recherches du Professeur Eldad Tzahor sont financées par le Centre de Diagnostic et de Thérapie du Cancer Yad Abraham, qu’il dirige ; le BIRAX ; l’Institut d’Imagerie Biomédicale et de Génomique Henry Krenter ; la Fondation de Recherche en Cardiovasculaire Daniel S. Shapiro ; et le Conseil Européen de la Recherche (ERC).


