10 Oct Éplucher les couches des tumeurs cérébrales
Les scientifiques de Weizmann ont cartographié des types communs de tumeurs cérébrales avec une résolution sans précédent – et ont identifié une raison possible pour laquelle certains patients ne répondent pas à un nouveau médicament.
Les cellules qui composent les tumeurs cérébrales cancéreuses sont extrêmement variées et créent parfois des formes tridimensionnelles uniques. Dès 1932, le neurochirurgien américain Percival Bailey a tenté d’étiqueter ces cellules et a découvert qu’elles pouvaient être divisées en plusieurs familles de cellules aux propriétés similaires. Plus de quatre-vingt-dix ans plus tard, nous en savons encore très peu sur l’identité des groupes de cellules qui composent les différents types de tumeurs cérébrales, sur l’organisation de ces groupes et sur la manière dont ils influencent l’évolution de la maladie et le résultat du traitement. C’est pourquoi le taux de réussite du traitement de la plupart des cancers du cerveau n’est généralement pas élevé.
Au cours de la dernière décennie, la technologie de séquençage génétique qui fonctionne au niveau de la cellule unique a permis d’examiner, dans les moindres détails et d’un seul coup, des milliers de cellules d’un même tissu, de comprendre quels gènes elles expriment, puis de les catégoriser et d’étudier le rôle de chaque groupe. Les scientifiques du groupe de recherche du Dr Itay Tirosh du Département de Biologie Cellulaire Moléculaire de l’Institut Weizmann des Sciences, en collaboration avec le laboratoire du professeur Mario L. Suvà du Massachusetts General Hospital, ont exploité cette technologie pour réexaminer certaines des questions restées sans réponse dans le domaine des tumeurs cérébrales.

(de gauche à droite) Dr Itay Tirosh, Dr Rouven Hoefflin, Dr Alissa Greenwald et Noam Galili Darnell
Le type le plus courant de tumeur cérébrale primaire est le gliome, qui provient des cellules de soutien qui assistent nos cellules nerveuses. Il existe deux types principaux de tumeurs gliomateuses : celles qui sont généralement moins agressives et qui présentent une mutation du gène codant pour une enzyme appelée IDH, et celles qui ne présentent pas cette mutation,sont très agressives et sont connues dans la terminologie médicale sous le nom de glioblastome. Ces dernières années, les chercheurs du laboratoire de Tirosh ont utilisé le séquençage de l’ARN de cellules individuelles pour analyser la composition cellulaire des deux types de tumeurs. Ils ont révélé que les cellules tumorales sont divisées en groupes, chacun d’entre eux exprimant un programme génétique unique qui détermine l’« état » biologique des cellules cancéreuses de ce groupe. Les chercheurs ont notamment découvert des groupes de cellules qui utilisent leurs programmes génétiques spécifiques pour imiter les cellules cérébrales normales.
Dans une nouvelle étude publiée récemment dans Cell, les chercheurs du laboratoire du Dr. Tirosh – dirigé par le Dr Alissa Greenwald, Noam Galili Darnell et le Dr Rouven Hoefflin – ont exploité des technologies qui permettent non seulement de séquencer l’ARN au niveau de la cellule unique, mais aussi de cartographier son expression dans l’espace. Cela leur a permis, pour la première fois, d’identifier les gènes qui s’expriment de manière unique dans chacune des milliers de zones d’une tumeur cérébrale. Ils ont ainsi pu cartographier avec précision l’organisation des glioblastomes et des tumeurs gliomateuses. Pour réaliser cette étude, ils ont prélevé des biopsies sur 13 patients atteints de glioblastomes et sur six patients atteints de gliomes présentant la mutation IDH.
La première découverte des chercheurs a été que les groupes de diverses cellules d’une tumeur gliomateuse ne sont pas répartis uniformément dans la tumeur ; ils sont plutôt concentrés dans divers environnements à l’intérieur de la croissance. Ces micro-environnements ne sont pas entièrement homogènes : les cellules d’autres groupes se trouvent toujours à proximité d’autres types de cellules. Dans l’étape suivante de l’étude, les chercheurs ont vérifié s’il existait des groupes de cellules tumorales qui se trouvent habituellement à proximité les uns des autres. Ils ont découvert que les cellules avaient non seulement des voisins préférés, mais aussi que ces couplages de bon voisinage étaient constants chez les différents patients.
Certaines paires de cellules voisines imitent le comportement naturel du tissu cérébral. Par exemple, les cellules qui imitent les cellules mères de la cellule de soutien de l’oligodendrocyte ont été trouvées à proximité des cellules endothéliales, qui tapissent les parois des vaisseaux sanguins. Ce couplage se produit également dans les tissus sains, puisque les cellules endothéliales libèrent des substances vitales pour la survie et la prolifération des cellules précurseurs d’oligodendrocytes. De même, des cellules imitant les cellules progénitrices de neurones ont été trouvées dans les parties de la tumeur qui ont pénétré dans le tissu cérébral sain, tout comme les cellules progénitrices du tissu sain migrent lorsque le tissu est régénéré.
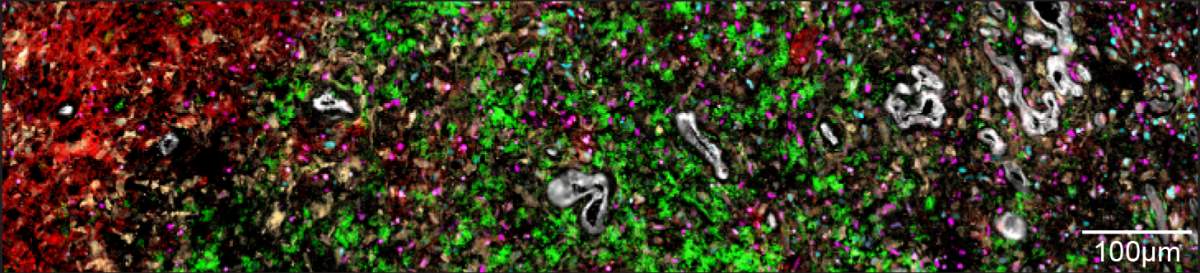
Les couches des tumeurs du glioblastome : La couche interne contient le cœur de la tumeur, constitué de cellules nécrosées qui ne reçoivent pas d’oxygène (rouge) ; la deuxième couche contient des cellules cancéreuses qui imitent celles du tissu conjonctif embryonnaire (jaune) ; la troisième couche contient des cellules immunitaires (vertes) et des cellules sanguines (blanches) ; les cellules de la quatrième couche de la tumeur reçoivent de l’oxygène et imitent le tissu cérébral sain (rose et bleu).
En prenant une vue d’ensemble pour mieux comprendre ces couplages, les chercheurs ont réalisé que les cellules créaient cinq couches distinctes en s’organisant dans des environnements séparés à l’intérieur de la tumeur. La couche la plus interne – le cœur de la tumeur – est constituée de cellules nécrosées, qui ne reçoivent pas suffisamment d’oxygène pour survivre. Dans la couche entourant le noyau nécrotique, les chercheurs ont trouvé des cellules similaires au tissu conjonctif embryonnaire, ainsi que d’autres cellules, notamment des cellules du système immunitaire responsables de l’inflammation. La troisième couche était principalement constituée de vaisseaux sanguins, de cellules endothéliales formant les parois des vaisseaux sanguins et d’autres cellules du système immunitaire.
Les cellules des deux couches externes de la tumeur ne souffrent pas d’un manque d’oxygène. Cela permet à des groupes de cellules tumorales qui imitent le tissu cérébral sain – les progéniteurs des neurones et les cellules de soutien – de se développer dans la quatrième couche. La cinquième couche, la plus externe, contient du tissu cérébral sain, dans lequel la tumeur pénètre. Ces résultats concernant les différentes couches d’une tumeur indiquent que le moteur de la structure en couches de la tumeur est le manque d’oxygène, qui s’aggrave au fur et à mesure que la maladie progresse et que la tumeur se développe.
Sur la base de ces résultats, les chercheurs ont remarqué une structure beaucoup plus chaotique dans les tumeurs moins agressives – qui sont aussi généralement plus petites – et dans les zones de la tumeur où l’oxygène est abondant. Dans la plupart des gliomes présentant la mutation IDH, par exemple, il n’y a généralement pas de tissu nécrotique et la structure de la tumeur est désorganisée ; dans les rares cas où il y a du tissu nécrotique, les biopsies montrent également une structure relativement bien ordonnée.
« Nous avons découvert qu’une structure spatiale organisée est caractéristique des tumeurs les plus agressives », explique Tirosh. « Le manque d’oxygène dans l’environnement des cellules tumorales influence le programme génétique qu’elles expriment et donc leur état. Au fur et à mesure que la tumeur se développe, des couches distinctes se forment, dont certaines peuvent être moins accessibles aux médicaments et aux cellules du système immunitaire, ce qui pourrait rendre la tumeur plus résistante. »
L’évolution de l’état des cellules cancéreuses
Les chercheurs du laboratoire du Dr. Tirosh ont utilisé les informations qu’ils ont recueillies sur la composition cellulaire des tumeurs de gliome pour déterminer comment un nouveau médicament prometteur a aidé certains patients atteints de ce type de cancer. Pour ce faire, ils ont utilisé des biopsies de tumeurs de trois patients qui avaient participé à un essai clinique du nouveau médicament et qui avaient répondu au traitement, ainsi que des biopsies de six patients qui n’avaient subi aucun traitement. Pour compléter le tableau, ils ont également utilisé les données de biopsies prélevées sur 23 autres patients qui avaient pris le médicament et 134 patients qui ne l’avaient pas pris.
L’équipe de recherche, dirigée par le Dr Avishay Spitzer, a découvert que le médicament, qui agit en inhibant l’enzyme IDH mutante, entraînait une modification du programme génétique exprimé par les cellules. En fait, le traitement encourage les cellules souches cancéreuses à se différencier en cellules matures, réduisant ainsi leur capacité à se diviser rapidement, ce qui bloque la progression de la maladie.

Dr. Avishay Spitzer
Les chercheurs ont émis l’hypothèse que si le médicament agit en provoquant la différenciation des cellules cancéreuses en cellules matures, la mutation attaquant le gène essentiel au processus de différenciation pourrait expliquer les cas dans lesquels le médicament ne fonctionne pas. Dans les biopsies prélevées sur les patients n’ayant pas reçu le médicament, ils ont identifié un certain gène lié à de faibles niveaux de cellules cancéreuses matures. Lorsqu’ils ont réduit ce gène au silence dans un modèle murin de cancer, ils ont constaté, comme prévu, que le médicament ne fonctionnait pas. « Cela indique que la mutation génétique que nous avons identifiée pourrait être un marqueur biologique nous permettant de déterminer à l’avance quels patients bénéficieront du traitement et lesquels n’en bénéficieront pas », explique le Dr. Tirosh. Ces nouveaux résultats pourraient également aider à trouver un traitement combinant les inhibiteurs de l’IDH avec un autre médicament qui encourage le processus de différenciation et augmente l’impact du traitement sur la tumeur.
« Nos deux études les plus récentes ont révélé les forces qui façonnent le caractère des cellules cancéreuses dans une tumeur, que ce soit dans leur environnement intact ou dans un environnement résultant d’une thérapie qui modifie le programme génétique des cellules », expliquele Dr. Tirosh. « Ces résultats ouvrent la voie à une nouvelle approche du traitement du cancer, car une fois que nous connaîtrons les groupes de cellules qui peuplent chaque zone de la tumeur et que nous saurons comment une cellule peut passer d’un état à l’autre, nous pourrons peut-être mettre au point de nouveaux traitements ciblés qui modifieront l’évolution de la maladie. Le fait de comprendre que la composition des cellules au sein de la tumeur et sa structure tridimensionnelle sont liées au niveau d’agressivité de la tumeur pourrait également conduire à de nouvelles méthodes de diagnostic qui ne reposent pas uniquement sur le volume de la tumeur et les mutations qu’elle contient ».
La Science en Chiffres
La durée médiane de survie pour les personnes diagnostiquées avec un glioblastome n’est que de 14 mois ; pour celles diagnostiquées avec un oligodendrogliome de grade 2 – le gliome IDH mutant – elle est de 11 ans.


