
06 Oct Les virus qui combattent la maladie : Une surprenante arme de précision contre la maladie de Crohn et la colite ulcéreuse
Comment pouvons-nous tuer sélectivement les bactéries intestinales nocives qui provoquent des maladies inflammatoires de l’intestin ou d’autres troubles ? Les chercheurs suggèrent d’utiliser des virus spécialisés
Les myriades de microbes présents dans notre intestin, collectivement appelés le microbiome, sont considérés comme importants pour notre santé, mais ils peuvent aussi abriter des bactéries qui contribuent aux maladies inflammatoires de l’intestin ou à d’autres troubles. Or, il est actuellement impossible de cibler ces bactéries pathogènes sans nuire aux microbes bénéfiques environnants. Les antibiotiques tuent les microbes bénéfiques en même temps que les microbes nuisibles et, dans tous les cas, ils ont tendance à déclencher une résistance bactérienne et à avoir des effets secondaires. Dans une étude publiée dans Cell, des chercheurs de l’Institut Weizmann des Sciences ont démontré la faisabilité d’une thérapie potentielle pour tuer les bactéries intestinales responsables de l’inflammation de manière ciblée : en utilisant des virus qui les infectent.
Les phages, ou bactériophages, comme on appelle ces virus, sont les organismes les plus abondants sur Terre ; on les trouve partout où il y a des bactéries, y compris dans l’intestin humain. Les tentatives d’utilisation de ces virus dans le traitement des maladies infectieuses remontent au début du XXe siècle, juste après la découverte des phages, mais cette voie de recherche a été abandonnée peu après l’avènement des antibiotiques. Dans la nouvelle étude, les chercheurs de Weizmann ont recruté des phages pour éliminer les bactéries qui ne provoquent pas seulement des maladies infectieuses, mais aussi des inflammations et des dommages intestinaux, contribuant ainsi aux maladies inflammatoires de l’intestin.

De gauche à droite : Dr. Rafael Valdes Mas, Dr. Sara Federici, Prof. Eran Elinav et Dr. Denise Kviatcovsky
« Il existe des milliers de phages différents, et leur grand avantage est que chacun d’entre eux est spécialisé dans l’attaque d’un type de bactérie différent », explique le professeur Eran Elinav du Département d’Immunologie des Systèmes de Weizmann, qui a dirigé l’équipe de recherche. « Cela nous a permis d’exploiter les phages pour cibler uniquement les bactéries intestinales qui contribuent à la maladie. À notre connaissance, il s’agit de la première approche « miracle » promettant une suppression précise des microbes intestinaux pathogènes, sans nuire au microbiome environnant. »
L’étude, menée en collaboration avec le professeur Rotem Sorek du Département de Génétique Moléculaire de Weizmann, a été dirigée par les Drs Sara Federici, Rafael Valdés Mas et Denise Kviatcovsky, stagiaires postdoctoraux du laboratoire du professeur Elinav, ainsi que par le Dr Sharon Kredo-Russo et d’autres chercheurs de BiomX Inc, une entreprise de microbiologie qui développe en phase clinique de nouvelles thérapies utilisant des phages ciblant des bactéries pathogènes spécifiques. Elle se base sur des recherches de l’Institut Weizmann sous licence exclusive de « Yeda Research and Development Company Ltd », la branche de transfert de technologie de Weizmann.
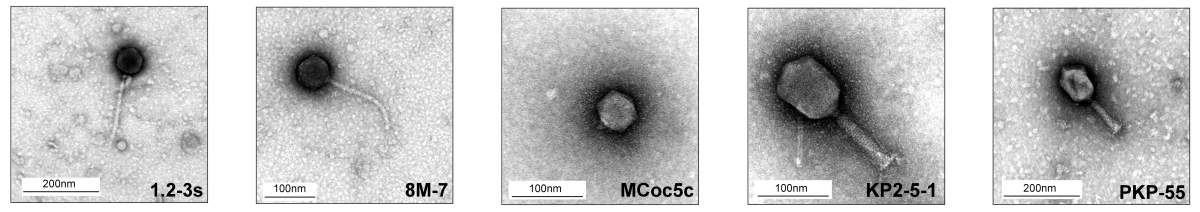
Composants d’un cocktail de cinq phages pour traiter l’inflammation intestinale observés au microscope électronique
Les scientifiques ont commencé par identifier avec précision les souches bactériennes qui jouent un rôle dans l’inflammation intestinale humaine. Ils ont comparé la composition des microbes intestinaux de volontaires sains à celle de personnes atteintes de deux formes majeures de maladies inflammatoires de l’intestin, la colite ulcéreuse et la maladie de Crohn. Une analyse informatique détaillée leur a permis d’identifier plusieurs souches bactériennes absentes chez les individus sains, qui étaient très largement représentées chez les personnes atteintes de la maladie, en particulier chez celles dont l’état s’aggravait. Les participants à l’étude ont été recrutés dans quatre pays situés dans différentes parties du monde – France, Allemagne, Israël et États-Unis – afin de s’assurer que les résultats seraient valables quel que soit le lieu.
Après avoir identifié plusieurs souches de la bactérie Klebsiella pneumoniae comme contribuant probablement à l’inflammation intestinale, les chercheurs ont confirmé cette découverte en transplantant ces bactéries dans des souris utilisées pour l’étude des maladies inflammatoires de l’intestin. Et en effet, les souches humaines de Klebsiella pneumoniae associées à cette maladie ont aggravé l’inflammation et les dommages intestinaux chez les souris receveuses.
Ensuite, les chercheurs ont passé en revue des milliers de phages et en ont sélectionné une quarantaine qui étaient les plus actifs contre les souches bactériennes humaines qu’ils avaient identifiées comme étant liées à l’inflammation intestinale. Toutefois, il ne suffit pas d’appliquer les phages, car les bactéries et les phages se livrent à une course aux armements permanente, dans laquelle les bactéries développent sans cesse de nouvelles résistances aux phages.
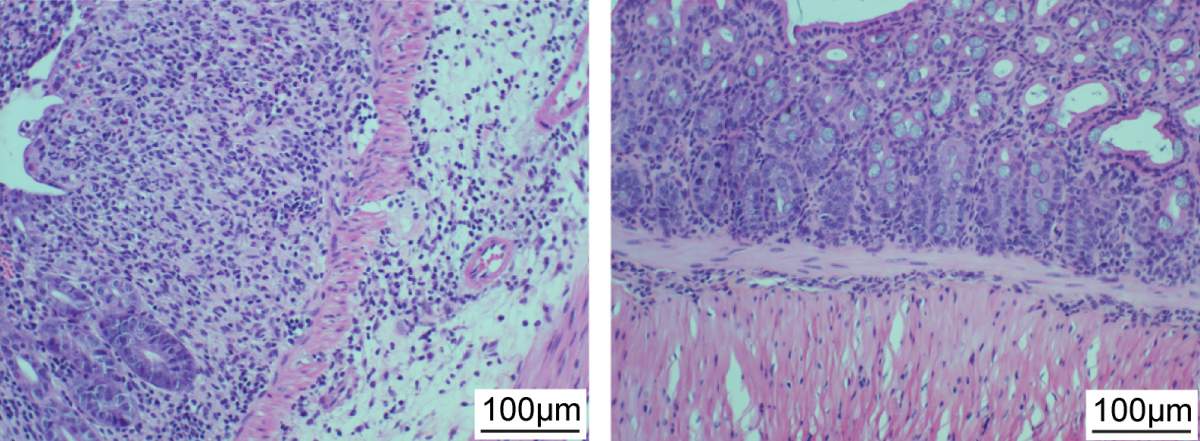
Paroi intestinale d’une souris endommagée quand exposée à des souches causant une inflammation (gauche). La détérioration est atténuée quand la souris a reçu un cocktail de cinq phages ciblant ces souches bactériennes (droite)
CRISPR, par exemple, un outil courant d’édition de gènes, est basé sur un mécanisme de protection que les bactéries utilisent pour identifier et détruire l’ADN des phages. Les scientifiques de Weizmann ont utilisé des connaissances récentes sur les mécanismes moléculaires de cette course aux armements afin de donner à leurs phages l’avantage sur les bactéries. En d’autres termes, ils ont recherché la combinaison idéale de phages qui empêcherait les bactéries de riposter. Un cocktail de 5 phages a été sélectionné sur la base de profils génétiques, de caractéristiques structurelles révélées par la microscopie électronique et d’un vaste criblage combinatoire pour l’activité contre diverses souches de Klebsiella pneumoniae, y compris celles qui sont résistantes aux antibiotiques. Ensemble, ces 5 phages ont empêché l’émergence de mutants bactériens susceptibles de propager la résistance.
Dans une coupelle de laboratoire, le cocktail s’est révélé efficace pour tuer les Klebsiella pneumoniae obtenues chez des patients atteints de maladies inflammatoires de l’intestin. Dans une étude ultérieure menée sur des souris, le cocktail a réduit de manière significative l’inflammation intestinale et les lésions tissulaires causées par ces souches bactériennes, ainsi que la mortalité liée à la maladie inflammatoire. Dans un système de laboratoire simulant l’intestin humain, il a été démontré que deux phages représentatifs du cocktail étaient stables lorsqu’ils étaient utilisés avec des antiacides. Dans un essai clinique de suivi de phase I sur 18 volontaires sains, les phages ont été bien tolérés. Il est important de noter que les phages ont persisté et se sont même multipliés dans les intestins humains au fil du temps, sans provoquer de changements indésirables et hors cible dans le reste des microbes intestinaux.
Si le cocktail de phages s’avère sûr et efficace lors d’essais cliniques de plus grande envergure, il pourrait servir de base au développement de thérapies non seulement pour les maladies inflammatoires de l’intestin, mais aussi pour d’autres troubles affectés par les microbes intestinaux, notamment l’obésité, le diabète, les maladies neurodégénératives et peut-être même le cancer.
« Notre vision est de développer à terme des thérapies personnalisées pour une variété de troubles, dans lesquelles les souches de bactéries intestinales responsables de la maladie seront identifiées chez chaque patient et un cocktail de phages sera conçu pour tuer uniquement ces souches », explique M. Elinav.
Les recherches du professeur Eran Elinav sont soutenues par le Centre Jeanne et Joseph Nissim pour la Recherche sur les Sciences de la Vie, l’Institut de la Société Suisse pour la Recherche sur la Prévention du Cancer, l’Institut Sagol pour la Recherche sur la Longévité, le programme Bridge Sagol Weizmann-MIT, le Fonds de Recherche sur le Coronavirus de la Fondation Norman E. Alexander Family M., le Fonds Leona M. et Harry B. Helmsley Charitable Trust ; la Rising Tide Foundation ; la Mike and Valeria Rosenbloom Foundation ; la Adelis Foundation ; la Ben B. and Joyce E. Eisenberg Foundation ; la Isidore and Penny Myers Foundation ; Miel de Botton ; la famille Vainboim ; et Charles S. Rothschild. Le professeur Elinav dirige le Belle S. and Irving E. Meller Center for the Biology of Aging et est titulaire de la chaire d’immunologie Sir Marc and Lady Tania Feldmann. La chaire de chercheur Vera Rosenberg Schwartz soutient un scientifique dans son laboratoire


