10 Mai Une question de survie : Comment le système immunitaire fixe ses priorités
Lorsqu’une deuxième infection succède à une première, les deux branches de notre système immunitaire peuvent s’affronter.
Même après avoir vaincu une infection virale, notre système immunitaire reste actif, nous protégeant de tout virus persistant ou de toute maladie récurrente. Mais que se passe-t-il si nous attrapons une infection bactérienne – par exemple une intoxication alimentaire à la salmonelle provenant d’une soupe au poulet à emporter – alors que nous nous remettons d’une grippe ou du COVID-19 ? Une nouvelle étude de l’Institut Weizmann des Sciences, publiée dans Immunity, montre que dans de tels cas, le système immunitaire a une façon intelligente de fixer des priorités, qui pourrait être exploitée pour le développement de futures thérapies contre les maladies auto-immunes.
Cette hiérarchisation implique les deux branches de l’immunité : innée et adaptative. L’immunité innée, première ligne de défense de l’organisme, entre en action dès que le système immunitaire détecte une invasion par des virus, des bactéries ou d’autres agents pathogènes, déployant ses cellules et ses produits biochimiques dans une vaste offensive pour neutraliser les envahisseurs. L’immunité adaptative, en revanche, peut prendre plusieurs jours pour déployer ses armes : des cellules spécialisées, ainsi que des anticorps qui sont conçus pour se lier à différents envahisseurs avec une précision exquise. Les anticorps restent en place pendant des mois, voire des années, offrant ainsi une sécurité durable.
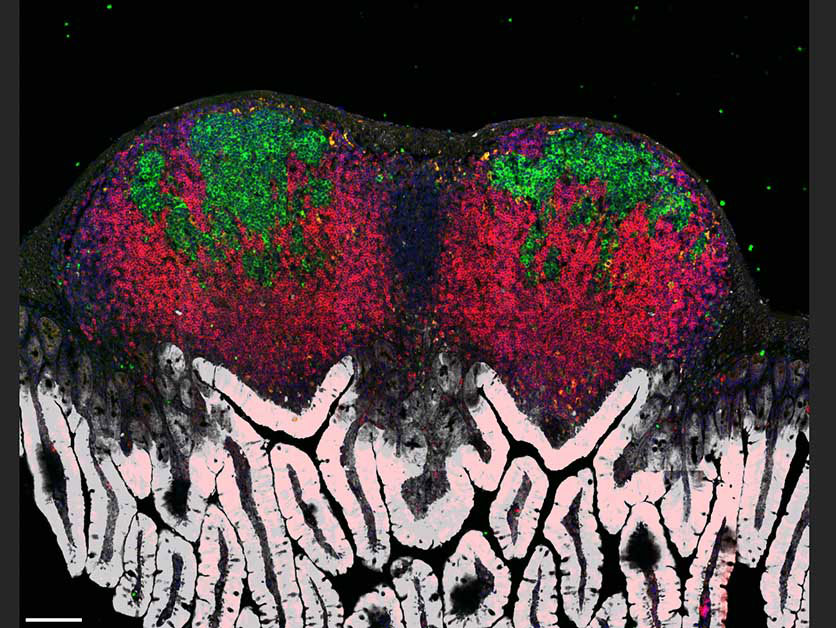
La paroi interne de l’intestin d’une souris présente des projections en forme de doigts (en blanc) et abrite des organes lymphatiques (en rouge) contenant des centres germinatifs (en vert). Vue en microscopie confocale
Cela signifie que l’immunité innée et l’immunité adaptative se manifestent généralement à différents stades d’une infection. Mais lorsqu’une infection est suivie d’une autre – par exemple, lorsqu’une personne ayant surmonté un virus de la grippe contracte une infection bactérienne telle que la salmonelle – les deux branches sont obligés de passer à la vitesse supérieure en même temps : L’immunité innée commence à combattre la bactérie tandis que l’immunité adaptative est encore occupée à fabriquer des anticorps contre le virus de la grippe.
Une équipe dirigée par le professeur Ziv Shulman du département d’immunologie de Weizmann a cherché à comprendre comment les deux branches de l’immunité interagissent lors d’un tel chevauchement. Dans une étude menée sur des souris, sous la direction du doctorant Adi Biram, ils ont découvert que l’interaction se termine par un choc : l’infection par la salmonelle interfère avec la fabrication d’anticorps contre la grippe. En d’autres termes, lorsqu’il est confronté à une menace mortelle, le système immunitaire désactive les mécanismes nécessaires à une protection à long terme et s’attaque plutôt au danger le plus urgent.

(de gauche à droite) Prof. Ziv Shulman et Dr. Adi Biram. L’établissement de priorités est la clé de la productivité
Les chercheurs ont révélé que la salmonelle ne produit pas cet effet directement. En effet, lorsqu’elle infecte les ganglions lymphatiques, elle déclenche une alarme qui atteint la moelle osseuse et incite les cellules de l’immunité innée, les monocytes, à quitter rapidement la moelle pour combattre la bactérie. Ces monocytes inondent en masse les ganglions lymphatiques, d’où ils lancent une attaque contre la salmonelle. Mais au cours de ce processus, du fait de leur activité antimicrobienne, ces cellules modifient l’environnement à l’intérieur des ganglions lymphatiques, en libérant divers produits chimiques et en provoquant un manque d’oxygène local.
La plupart des cellules immunitaires s’adaptent à cette pénurie en modifiant leur métabolisme et en brûlant du glucose comme source d’énergie au lieu de l’oxygène. Mais pour un sous-ensemble de cellules B qui résident dans les ganglions lymphatiques, dans des structures microscopiques appelées centres germinaux, le manque d’oxygène est fatal : incapables d’adapter leur métabolisme, ces cellules B s’étouffent et meurent. C’est précisément ce sous-ensemble de cellules qui joue un rôle clé dans l’immunité adaptative, en générant des anticorps ayant la meilleure adéquation possible contre l’agent pathogène envahissant. La mort de ces cellules met un terme à la production des anticorps nécessaires à une protection durable contre l’infection virale.
« C’est l’un ou l’autre : lorsque vous combattez une bactérie mortelle, vous ne pouvez pas vous préoccuper d’une immunité durable », explique le prof. Shulman. « La destruction de la salmonelle est prioritaire car c’est une question de survie. »
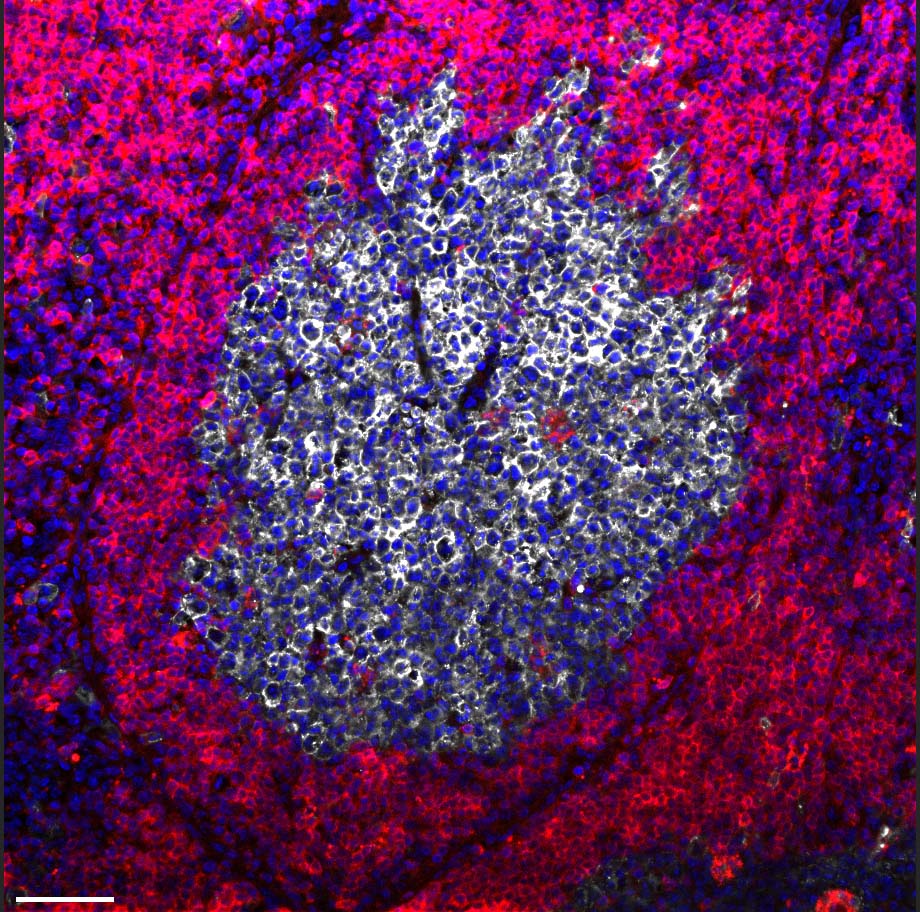
Un centre germinal dans un ganglion lymphatique, imagé par microscopie confocale ; les noyaux cellulaires sont en bleu.
Les résultats de l’étude pourraient avoir des applications dans divers domaines de l’immunologie. Actuellement, certaines protéines bactériennes sont parfois ajoutées aux vaccins afin d’en améliorer l’efficacité, mais l’étude suggère que ces ajouts pourraient se retourner contre eux, en nuisant à la production d’anticorps. En outre, si elles sont confirmées chez l’homme, ces nouvelles découvertes pourraient conduire à un nouveau type de thérapie pour les maladies auto-immunes causées par la production erronée d’anticorps, par exemple la polyarthrite rhumatoïde et le lupus. Une telle thérapie exploiterait les monocytes de la moelle osseuse pour stopper la production d’anticorps responsables de la maladie.
La science en chiffres
90 % des décès survenus pendant la pandémie de grippe de 1918 seraient dus à une pneumonie secondaire à pneumocoques. Dans une vaste étude menée au Rabin Medical Center, des infections bactériennes secondaires sont survenues chez 12,6 % des patients atteints de COVID-19 et chez 8,7 % des patients atteints de la grippe.
Les recherches du professeur Ziv Shulman sont soutenues par le Moross Integrated Cancer Center, la Rising Tide Foundation, la Azrieli Foundation, la Ben B. and Joyce E. Eisenberg Foundation, le Wolfson Family Charitable Trust & Wolfson Foundation, Elie Hirschfeld et le Dr Sarah Schlesinger, et Miel de Botton.


