04 Sep Les spermatozoïdes sont les bienvenus – mais leurs mitochondries doivent disparaître
Pourquoi n’héritons-nous que des mitochondries maternelles ? Une nouvelle étude montre comment les versions paternelles sont délibérément détruites.
Quelques minutes après la fécondation, l’œuf d’une drosophile se transforme en une scène de la bataille des sexes. L’œuf attaque et détruit les « centrales énergétiques » cellulaires, ou mitochondries, du spermatozoïde qui l’a fécondé, de sorte que seules ses propres mitochondries subsistent. Ces conclusions d’une nouvelle étude de l’Institut Weizmann des Sciences, publiée dans Nature Communications, pourraient donner des indications sur les traitements avancés de la fécondation et éclairer un mystère de longue date : comment et pourquoi héritons-nous toutes nos mitochondries de nos mères ?
Les mitochondries paternelles disparaissent peu après la fécondation chez pratiquement toutes les espèces, des plantes à reproduction sexuée aux mammifères, en passant par les champignons et les insectes, y compris l’homme. Une théorie veut que les mitochondries paternelles soient simplement diluées par les mitochondries maternelles, beaucoup plus abondantes, mais une autre suggère qu’elles sont activement éliminées par l’œuf.
Il y a une dizaine d’années, le laboratoire du professeur Eli Arama, du Département de Génétique Moléculaire de Weizmann, a fourni des preuves cruciales en faveur de la théorie de l’élimination active. La nouvelle étude, dirigée par Sharon Ben-Hur, étudiante en doctorat, révèle les détails moléculaires de cette élimination, montrant que l’ovule lance une attaque délibérée et ciblée sur les mitochondries du spermatozoïde.
« Il est possible que les mitochondries paternelles soient porteuses de composants nocifs, mais elles peuvent aussi contenir certains dons du père », explique le Prof. Arama. Quoi qu’il en soit, leur décomposition peut avoir une incidence cruciale sur le développement embryonnaire.

(g-d) Dr. Keren Yacobi-Sharon, Shoshana Sernik, Prof. Eli Arama, Sharon Ben-Hur, Dr. Eyal Schejter and Dr. Alina Kolpakova
Le spermatozoïde de la drosophile est l’un des plus grands dans la nature, ce qui en fait un excellent modèle pour ces études. Ses mitochondries ne sont pas dispersées, mais fusionnées le long de sa queue en une seule structure allongée. Pourtant, comme l’a montré l’équipe, l’œuf de drosophile parvient à détruire même cette grande formation.
Sharon Ben-Hur et ses collègues ont constaté qu’à peine le spermatozoïde pénètre-t-il dans l’œuf qu’il est accueilli par des nuées de grappes de vésicules. D’une manière manifestement intentionnelle et préprogrammée, ces amas fusionnent immédiatement pour former une gaine vésiculaire couvrant toute la longueur de la queue du spermatozoïde. Ensuite, tous les éléments de la structure mitochondriale de la queue du spermatozoïde, y compris sa gaine, sont décomposés en plus petits morceaux.
Après avoir étudié des milliers d’embryons de drosophiles, Sharon Ben-Hur et son équipe ont été surpris de découvrir que les vésicules formant la gaine contiennent des molécules impliquées dans l’immunité innée. Des recherches plus approfondies ont montré que la surface extérieure des gaines vésiculaires abritait de grandes quantités d’une protéine appelée Rubicon, connue pour jouer un rôle dans une voie immunitaire appelée LC3-associated phagocytosis (phagocytose associée à LC3) ou, en abrégé, LAP, connue pour fonctionner contre les microbes envahissants.
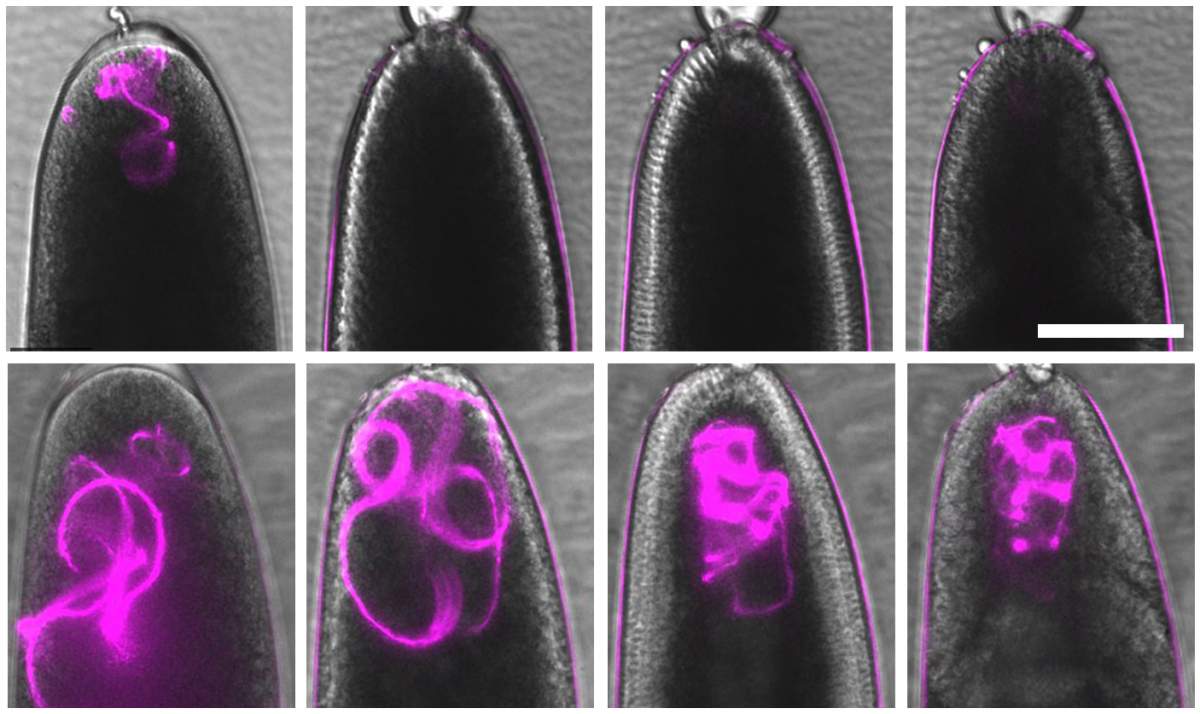
Les mitochondries paternelles d’une drosophile (magenta) sont clairement visibles dans l’œuf plusieurs minutes après la ponte (en haut à gauche), mais sont complètement détruites au bout d’une heure (en haut, deuxième à partir de la gauche). Chez une mouche mutante dépourvue de la protéine Rubicon (en bas à gauche), ces mitochondries ne sont pas détruites, même 1, 2 ou 3 heures après la ponte (rangée du bas, deuxième, troisième et quatrième à partir de la gauche).
Cette découverte a conduit les chercheurs à décrypter l’ensemble de la voie impliquée dans la dégradation des mitochondries et à révéler qu’elle est en effet similaire à la LAP. En outre, tout comme cela se produit dans les cellules immunitaires qui ciblent les microbes, l’étape finale de la LAP dans l’œuf implique le recrutement de lysosomes, les organites de recyclage de la cellule, qui achèvent la dégradation des mitochondries.
« Nous avons découvert que l’œuf réaffecte une voie de l’immunité innée pour détruire les mitochondries paternelles. D’une certaine manière, il les traite comme de dangereux intrus », explique Sharon Ben-Hur. Cette découverte du recours par l’œuf à des mécanismes antimicrobiens s’inscrit dans l’hypothèse dominante concernant les origines primordiales de la mitochondrie : Dans un passé très ancien, les mitochondries ont pu être des bactéries qui ont envahi les cellules d’un organisme supérieur et y sont restées parce que l’invasion s’est avérée bénéfique pour les deux parties.
En expliquant comment l’œuf gère la destruction de structures aussi énormes que les mitochondries paternelles de la drosophile, l’étude pourrait ouvrir une nouvelle voie de recherche en biologie cellulaire. Ses conclusions pourraient guider la recherche de méthodes jusqu’ici inconnues par lesquelles les cellules dégradent de grandes structures telles que des organites entiers endommagés.
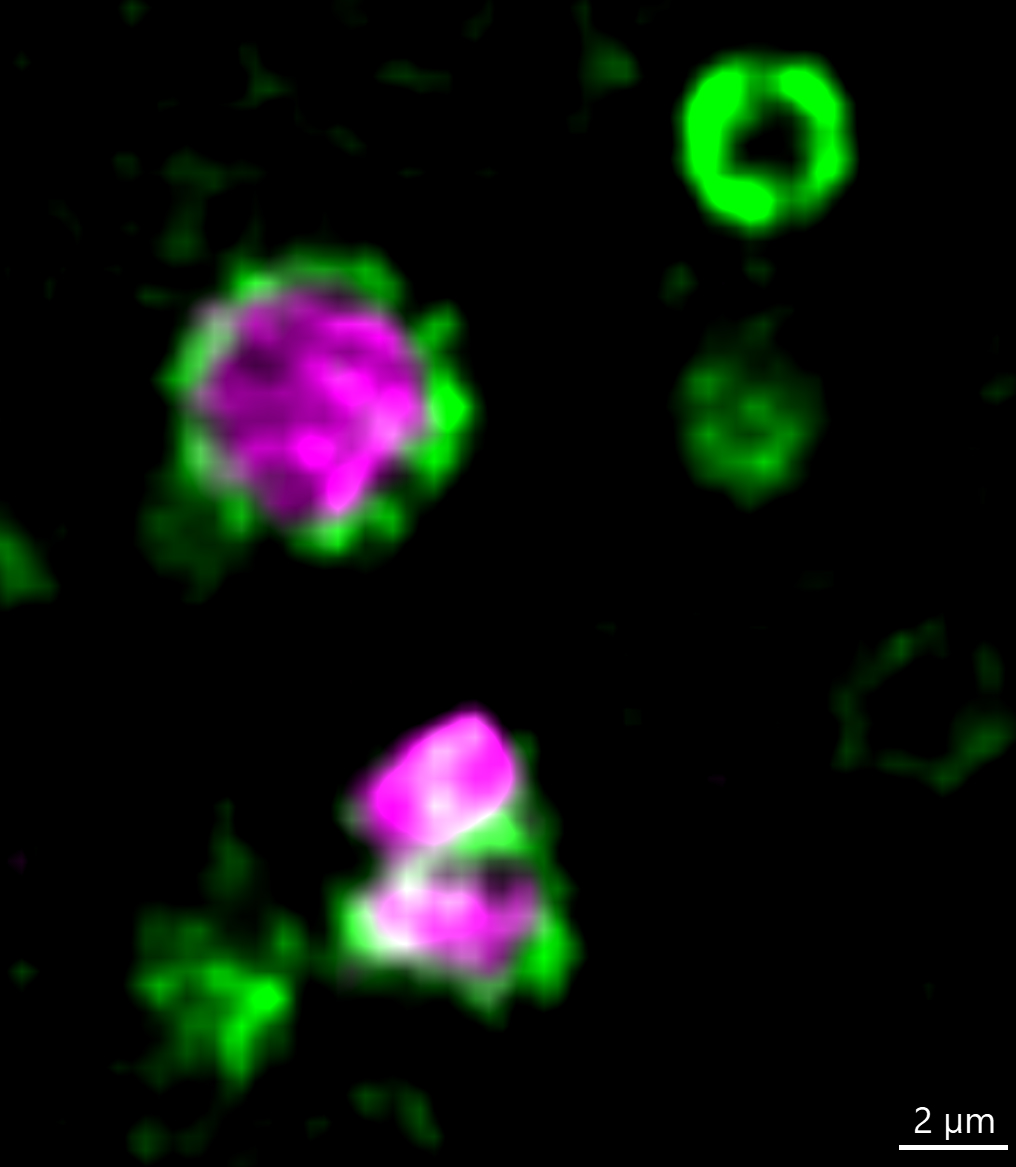
Coupe transversale d’une mitochondrie paternelle de drosophile (magenta) entourée d’une gaine contenant une abondante protéine Rubicon (verte).
L’étude pourrait également fournir de nouveaux indices sur les raisons pour lesquelles les mitochondries paternelles doivent être détruites. Une explication courante concerne la nécessité pour la cellule de maintenir la compatibilité entre ses deux génomes : l’un dans le noyau, qui résulte de la fusion de l’ADN maternel et de l’ADN paternel, et l’autre, différent, dans les mitochondries. Selon cette explication, cette compatibilité devrait être plus facile à réaliser lorsque toutes les mitochondries ne portent que de l’ADN maternel, car un trop grand nombre d’ADN différents risquerait de s’opposer. Mais ce n’est peut-être pas tout à fait vrai. Les mitochondries paternelles sont beaucoup plus nombreuses que les maternelles, et leur décomposition, tant chez la mouche des fruits que chez l’homme, se produit longtemps après l’élimination de leur ADN.
« Le fait que l’ovule ait recours à des mécanismes étonnamment agressifs pour détruire les mitochondries paternelles suggère qu’il y a urgence », explique le Prof. Arama. L’une des raisons possibles est que ces mitochondries pourraient contenir certains composants non ADN, tels que des ARN, qui sont délétères pour l’embryon ou, au contraire, de petites molécules non génétiques qui sont rendues disponibles par la destruction de la mitochondrie et qui pourraient être vitales pour le développement de l’embryon. En fait, lorsque Sharon Ben-Hur a créé des embryons de mouches mutantes dépourvues de la protéine Rubicon, ces embryons n’ont pas réussi à détruire les mitochondries paternelles et ne se sont pas développés correctement.
Les mitochondries paternelles chez l’homme et les autres mammifères sont-elles détruites par les mêmes mécanismes que chez la drosophile ? Certaines similitudes sont déjà apparues, notamment l’expression de la molécule LC3 sur les mitochondries paternelles et la présence d’amas de vésicules à proximité de la queue du spermatozoïde de mammifère après la fécondation.
Si ces similitudes sont confirmées par d’autres études, elles pourraient contribuer à améliorer les traitements de pointe en matière de fertilité. Par exemple, dans une technique courante de FIV, un seul spermatozoïde est injecté dans l’ovule pour augmenter les chances de fécondation, au lieu d’exposer l’ovule à plusieurs spermatozoïdes dans une éprouvette. Toutefois, des données provenant d’autres domaines de la biologie cellulaire suggèrent qu’un spermatozoïde injecté pourrait ne pas posséder les marqueurs nécessaires à la destruction de ses mitochondries, marqueurs qu’il aurait acquis s’il avait pénétré spontanément dans l’ovule. L’ajout de ces marqueurs pourrait potentiellement contribuer au succès du traitement.
D’autres traitements de fertilité consistent à remplacer les mitochondries de l’ovule par celles d’une donneuse, par exemple lorsque l’on sait que les mitochondries maternelles sont porteuses d’une mutation pathologique. Dans ce cas, la compréhension des mécanismes de destruction des mitochondries peut aider à garantir que les mitochondries de la donneuse sont correctement intégrées dans l’ovule fécondé.
La Science en Chiffres
La queue d’un spermatozoïde de drosophile mesure environ 1,8 millimètre de long, soit environ 30 fois plus que celle d’un spermatozoïde humain, qui mesure environ 60 microns (micromètres) de long.
Un ovule de mammifère mature contient entre 100 000 et 600 000 mitochondries, alors qu’un seul spermatozoïde de mammifère ne contient que 50 à 75 mitochondries.


