04 Juil Comment une bactérie sait-elle qu’il est temps d’agir ?
Les scientifiques étaient divisés sur la question de la division cellulaire ; une étude statistique comble le fossé.
Les cellules bactériennes ne se réveillent pas un matin et ne décident pas de devenir parents. Mais il y a un moment dans leur cycle cellulaire – après avoir suffisamment grandi et répliqué leurs génomes – où elles se séparent en deux, créant de nouvelles cellules qui répètent ensuite le processus. Qu’est-ce qui indique à la bactérie qu’il est temps de se séparer ? Les scientifiques sont divisés sur le sujet.
Ces dernières années, lorsqu’ils ont tenté de découvrir les signaux biologiques qui déterminent le moment où une bactérie se divise, les scientifiques se sont appuyés sur une technologie récemment développée qui leur permet de suivre les cycles de vie d’une seule cellule bactérienne et de tous ses descendants pendant des centaines de générations. Le problème est que les expériences utilisant ce système ont produit des modèles contradictoires, chacun attribuant le moment de la division cellulaire à un facteur différent. Dans une nouvelle étude, publiée dans Proceedings of the National Academy of Sciences (PNAS), une équipe dirigée par des chercheurs de l’Institut Weizmann des sciences a utilisé un raisonnement statistique pour révéler quel modèle de division cellulaire est le plus plausible. Cette méthode présente l’avantage d’aller directement à l’essentiel – identifier le facteur causal de la division – sans avoir à exposer les mécanismes biologiques exacts impliqués.

Prof. Ariel Amir
Lors de recherches antérieures, des scientifiques qui suivaient la division de cellules bactériennes avaient observé que les cellules augmentaient exactement du même volume entre le moment de la duplication de l’ADN et la division de la cellule. Ils en ont déduit que les processus indiquant à la cellule qu’elle doit se diviser en deux commencent pendant la phase de duplication du matériel génétique. Cependant, les études ont également montré que les cellules croissent exactement du même volume entre le moment de leur naissance et le moment où elles se divisent. Cette observation a conduit au développement d’un modèle contradictoire, selon lequel le compte à rebours de la division cellulaire commence dès la naissance de la cellule. Selon cette approche, une protéine régulatrice commence à s’accumuler dans les cellules dès le début, déclenchant une sorte de tic-tac qui se déclenche lorsque les niveaux de cette protéine atteignent un certain point. Pour résoudre cette contradiction, un troisième modèle a combiné les deux, proposant l’implication à la fois d’une protéine régulatrice et de la réplication génétique.
Ces modèles étaient tous basés sur la corrélation : Les scientifiques ont noté que les limites de croissance dans certaines parties du cycle des cellules bactériennes semblaient être synchronisées avec la division cellulaire. Mais, comme tout étudiant en sciences de première année peut vous le dire, corrélation n’est pas synonyme de causalité. En d’autres termes, l’accumulation de protéines ou la réplication de l’ADN peuvent se produire en même temps que le signal de division, sans qu’il y ait de relation de cause à effet avec ce signal.
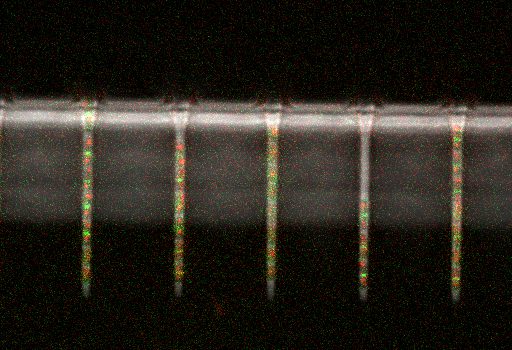
Le dispositif expérimental : Des canaux microfluidiques d’un micron de large dans lesquels des bactéries E. coli, marquées avec des marqueurs fluorescents, ont été cultivées et suivies sur plusieurs générations. Le marquage a permis de suivre les événements importants de leur cycle cellulaire au niveau des cellules individuelles.
Afin de trancher entre les deux modèles de division cellulaire, le professeur Ariel Amir, du Département de Physique des Systèmes Complexes de Weizmann, et une équipe internationale de scientifiques ont utilisé le test d’indépendance conditionnelle, un outil statistique mis au point par Judea Pearl, le scientifique israélo-américain qui a reçu le prix Turing pour ses travaux sur les techniques utilisées dans le cadre de cette approche. Les chercheurs ont appliqué ce test aux données recueillies, en collaboration avec l’université du Tennessee, sur la croissance de centaines de bactéries E. coli différentes dans différents lots. Certaines cellules ont été soumises à des conditions leur permettant de se diviser rapidement, tandis que d’autres ont été cultivées dans des conditions imposant une croissance plus lente. Les données comprenaient la chronologie des différentes étapes du cycle de vie des cellules, ainsi que la taille des cellules à chaque étape.
Les tests d’indépendance conditionnelle posent des questions de type « si-alors » qui peuvent révéler quelle corrélation est justement une coïncidence qui n’implique pas de causalité. Dans le cadre des travaux menés par Prathitha Kar, étudiante en recherche à Harvard, l’équipe a comparé des groupes de cellules bactériennes qui étaient de taille similaire lors de la phase de duplication de l’ADN, mais qui étaient de taille différente à la naissance. Si le modèle selon lequel le moment de la division cellulaire dépend uniquement de la duplication de l’ADN est correct, les cellules de taille similaire au moment de la duplication se diviseront à un moment similaire, quelle que soit leur taille à la naissance. En revanche, si le modèle est erroné et que c’est l’accumulation de protéines depuis la naissance qui détermine le moment de la division cellulaire, les cellules de taille différente à la naissance se diviseront à des moments différents et il y aura une corrélation entre la taille à la naissance et la taille au moment de la division.
Les chercheurs ont été surpris de découvrir que les deux modèles sont valables, mais pas de la manière proposée par le troisième modèle « hybride ». Lorsque les cellules bactériennes se développaient lentement, seuls les processus de duplication de l’ADN déterminaient le moment où une cellule se divisait. En revanche, lorsque la croissance des cellules est plus rapide, la situation devient plus complexe et les chercheurs découvrent que les processus qui commencent à la naissance et la duplication de l’ADN se combinent pour déterminer le moment où la cellule se divise. Enfin, les chercheurs ont mis en évidence un indice visuel indiquant que la division cellulaire avait atteint un point de non-retour : Une cellule est destinée à se diviser en deux cellules au moment où un anneau commence à se former en son centre.
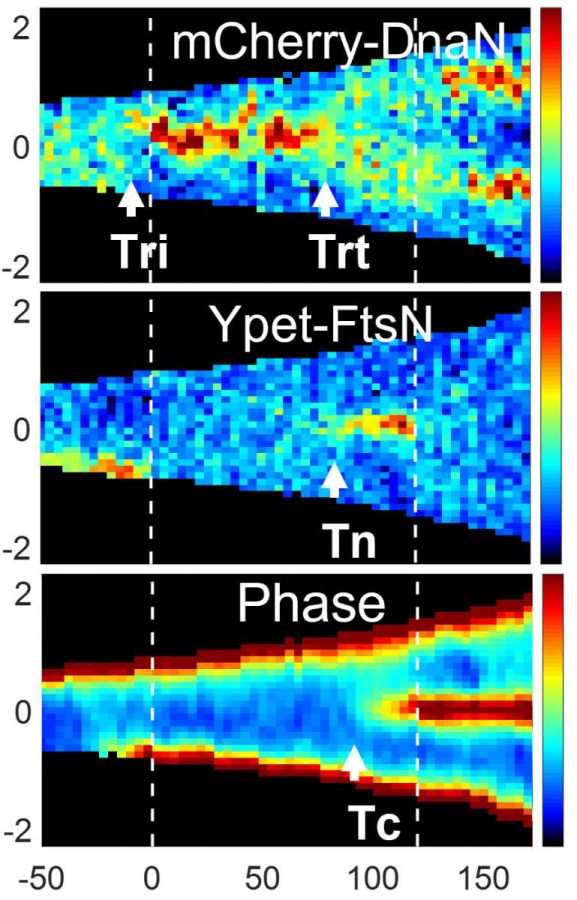
Les générations se succèdent : Suivi des changements survenant au fil du temps dans trois marqueurs fluorescents au niveau de cellules E. coli cultivées en laboratoire
Les scientifiques ont également utilisé le test d’indépendance conditionnelle pour réfuter une théorie communément admise selon laquelle le moment de la duplication de l’ADN dans une génération détermine de manière rigide ce moment dans la génération suivante. Ils ont plutôt montré que les processus qui se produisent dans la cellule mère après que la duplication de son ADN a déjà commencé peuvent affecter le moment où les cellules filles commencent à répliquer leur propre matériel génétique.
« L’utilisation de méthodes statistiques pour confirmer une relation de cause à effet nous permet de mieux comprendre les processus de croissance et de division des cellules bactériennes », explique le Prof. Amir. « Les tests d’indépendance conditionnelle sont couramment utilisés dans des domaines tels que l’épidémiologie, l’économie, etc. Je pense que la capacité à caractériser les processus de croissance et de reproduction d’un large éventail de pathogènes ouvrira la voie à la mise au point d’antibiotiques plus efficaces à l’avenir. »
Sriram Tiruvadi-Krishnan, Jaana Männik et Jaan Männik de l’Université du Tennessee ont également participé à l’étude.
La Science en Chiffres
Le temps de génération d’E. coli en laboratoire est d’environ 20 minutes ; le temps de génération chez l’homme est de plus de 25 ans.
Déchiffrer la vie
Le professeur Amir a pour objectif de décrypter les processus de la vie à l’aide de la physique et de modèles mathématiques. Depuis qu’il a rejoint le département de physique des systèmes complexes de l’Institut Weizmann en septembre 2022, ses recherches se sont concentrées sur le cycle de vie des bactéries et sur la compréhension des différents processus biophysiques qui se produisent à l’intérieur des cellules, notamment l’expression des protéines et les stratégies de recherche intercellulaire. Il utilise des modèles d’inférence causale et de physique statistique, sur lesquels il a rédigé un manuel d’introduction. Son équipe de recherche étudie également l’évolution microbienne à l’aide de modèles issus de la théorie des probabilités.
Le Prof. Amir a commencé sa carrière scientifique dans la physique théorique de la matière condensée, en étudiant les propriétés de la dynamique des verres d’électrons pour sa maîtrise et son doctorat à l’Institut Weizmann, sous la direction du professeur Yuval Oreg et du regretté professeur Yoseph Imry. Ensuite, en tant que chercheur postdoctoral à l’université de Harvard, il a été attiré par la recherche en biophysique, d’abord sous la direction du professeur David Nelson, puis dans son propre laboratoire. En dehors du laboratoire, il pratique l’escalade, la course à pied et le vélo. Sa femme, Lindy, et lui ont trois filles.


