12 Sep Pourquoi les patients atteints de cancer perdent-ils autant de poids ?
Le syndrome de dépérissement – un effet secondaire mortel du cancer – pourrait être diagnostiqué et traité à un stade précoce, selon une nouvelle étude.
Appliquer la même solution à des problèmes différents est une erreur courante, non seulement chez les humains, mais aussi dans notre système immunitaire. Inonder une plaie de globules blancs provoquant des inflammations peut être utile pour lutter contre une infection, mais lorsque le système immunitaire tente d’appliquer cette « solution » à un objectif différent – la lutte contre le cancer – il peut finir par favoriser la croissance de la tumeur. Dans une nouvelle étude, une équipe de chercheurs, dirigée par le professeur Ayelet Erez de l’Institut Weizmann des Sciences, a révélé comment les tumeurs cancéreuses utilisent cette réponse immunitaire à leur profit tout en affamant le corps de leur hôte – un effet dévastateur connu sous le nom de syndrome d’amaigrissement. Les scientifiques proposent une méthode pour prédire la perte de poids causée par le cancer et ouvrent la voie au développement de traitements possibles.
On sait depuis longtemps que les tumeurs cancéreuses reprogramment les processus métaboliques non seulement en leur sein mais aussi autour d’elles afin d’obtenir un approvisionnement régulier en nutriments essentiels. C’est pourquoi les traitements contre le cancer comprennent aujourd’hui des modulateurs métaboliques qui bloquent cette reprogrammation. Mais ces dernières années, les chercheurs se sont rendu compte que le cancer pouvait altérer les processus métaboliques de manière systémique, c’est-à-dire dans tout l’organisme du patient. L’une des conséquences les plus graves est le syndrome d’amaigrissement, c’est-à-dire une perte de poids rapide qui n’est pas liée au régime alimentaire du patient et qui ne peut pas être compensée par un apport calorique élevé. Ce syndrome survient chez les patients atteints de cancer dont le métabolisme est fortement perturbé.
 (g-d) Omer Goldman, Dr. Lital Adler et Prof. Ayelet Erez. Comment le cancer est gagnant aux dépens du corps
(g-d) Omer Goldman, Dr. Lital Adler et Prof. Ayelet Erez. Comment le cancer est gagnant aux dépens du corps
Le foie étant une plaque tournante du métabolisme qui détecte les changements métaboliques et y réagit, la nouvelle étude – dirigée par Omer Goldman de l’équipe de recherche du Prof. Erez au Département de Biologie Cellulaire Moléculaire de Weizmann – a exploré le lien entre le foie et le cancer. Les chercheurs ont cherché à comprendre si et comment un cancer se développant dans des organes éloignés affecte les processus du foie, et quel pourrait être le résultat pour la tumeur. À cette fin, O. Goldman a suivi les changements métaboliques dans des modèles murins de cancers humains du sein et du pancréas, en se concentrant sur le cycle de l’urée, une série de réactions biochimiques qui se déroulent dans le foie. Dans ce cycle, l’excès d’azote est transféré au foie sous forme d’ammoniaque, puis converti en urée pour être éliminé de l’organisme par l’urine.
Dans une étude réalisée en 2018 sur des enfants, l’équipe du Prof. Erez, en collaboration avec des collègues en Israël et à l’étranger, a découvert qu’un faible taux d’urée dans l’urine pouvait signaler la présence d’un cancer. Cela peut se produire lorsque le cancer garde pour lui le très précieux azote – un élément de base de tous les acides aminés de l’organisme – laissant moins de déchets azotés à expulser sous forme d’urée.
Dans cette recherche, les scientifiques ont d’abord identifié le stade auquel le cancer commence à perturber le métabolisme du foie. « Quelques jours après l’apparition du cancer, nous avons détecté une baisse de l’activité du cycle de l’urée », explique Goldman. « En conséquence, les acides aminés se sont accumulés dans le sang des souris, au lieu d’être décomposés dans le cycle. La tumeur utilisait l’azote de ces acides aminés pour assembler son ARN et son ADN. En raison de la défaillance du cycle de l’urée, un excès d’ammoniaque s’est également accumulé, ce qui a entravé la capacité des cellules immunitaires à lutter contre le cancer. »
Découvrir un cheval de Troyes dans le foie
Le défi suivant consistait à révéler exactement comment le cancer reprogramme les processus métaboliques dans le foie. Les scientifiques ont découvert qu’à peu près au moment où les changements métaboliques sont apparus, certains types de cellules immunitaires ont commencé à infiltrer le foie. Il s’agit de globules blancs libérés dans la circulation sanguine dans le cadre de la réponse inflammatoire destinée à combattre le cancer. En particulier, à mesure que le cancer progressait, le foie se remplissait d’un grand nombre de globules blancs matures et actifs appelés neutrophiles et monocytes.
Pour comprendre le lien entre l’afflux de globules blancs et le métabolisme du foie, l’équipe de recherche a séquencé des molécules d’ARN prélevées sur des cellules hépatiques à différents stades de la maladie. Leur analyse a révélé que lorsque le nombre de globules blancs augmentait, le foie cessait de produire une protéine appelée HNF4-alpha – connue pour être un régulateur principal des processus métaboliques – et diminuait sa production d’albumine, qui est cruciale pour prévenir les gonflements et les fuites des vaisseaux sanguins. Lorsque les niveaux de ces protéines dans le foie ont baissé, les souris ont commencé à perdre du poids.
Grâce à la thérapie génique, les scientifiques ont ensuite rétabli la production de HNF4-alpha dans le foie des souris, et ses niveaux sont restés élevés. En conséquence, les souris n’ont pas perdu de poids, leurs tumeurs ont diminué et leur taux de survie s’est amélioré.
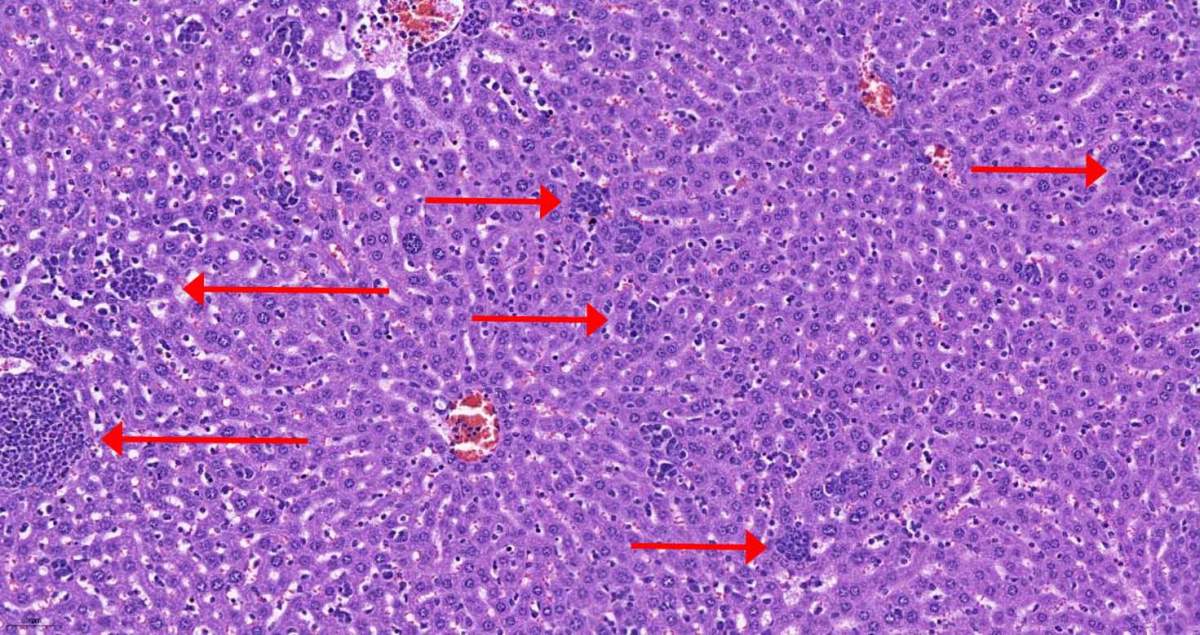
Tissu hépatique d’une souris femelle atteinte d’un cancer du sein. Les cellules du système immunitaire (amas de cellules sombres, marquées par des flèches) pénètrent dans le foie dès les premiers jours de l’apparition de la tumeur.
Ces résultats ont fourni des preuves solides que le syndrome d’amaigrissement est causé, au moins en partie, par une diminution du régulateur métabolique principal HNF4-alpha, provoquée par des cellules immunitaires infiltrant le foie. Ces recherches permettent d’espérer qu’à l’avenir, il sera possible de prévenir ou même de traiter ce syndrome, par exemple à l’aide de médicaments qui simuleraient la fonction de HNF4-alpha ou qui contreraient les effets de sa diminution.
En vue de ces applications, les scientifiques se sont concentrés, dans la présente étude, sur l’identification des patients à risque. Étant donné qu’il a été constaté que les changements métaboliques dans le foie se produisent bien avant l’apparition des symptômes du syndrome de dépérissement, les chercheurs se sont demandé si un examen de routine de la fonction hépatique au moment du diagnostic du cancer pourrait aider à prédire le risque que les patients développent le syndrome par la suite. Ils ont mis au point un modèle de diagnostic avec un score de fonction hépatique basé sur un test sanguin pour l’albumine et d’autres paramètres biochimiques sanguins liés au foie. Lorsqu’ils ont appliqué ce modèle à de vastes ensembles de données de patients atteints de cancer provenant des services de santé Clalit, du centre médical Sheba et du centre médical Sourasky de Tel Aviv, ils ont constaté une corrélation entre le profil hépatique mesuré au début de la maladie et le risque de syndrome de dépérissement, voire de mortalité, survenant ultérieurement.
« Il n’existe aucun traitement pour le syndrome de dépérissement, même s’il est évident que pour vaincre le cancer, il faut maintenir le corps du patient en bonne forme », explique le Prof. Erez. « Une meilleure compréhension de la manière dont le cancer modifie les processus métaboliques centraux dès le début de la maladie, combinée au développement continu de traitements génétiques visant à prévenir ces changements, pourrait bientôt se traduire par de nouvelles thérapies disponibles pour les patients aux premiers stades du cancer. »
La Science en Chiffres
Selon une estimation de 2014, le syndrome de dépérissement touche 50 à 80 % des patients atteints de cancer et est responsable d’environ 20 % des décès dus au cancer
Le professeur Ayelet Erez est à la tête du David and Fela Shapell Family Center for Genetic Disorders Research (Centre Familial David et Fela Shapell pour la Recherche sur les Troubles Génétiques). Ses recherches sont soutenues par le Moross Integrated Cancer Center, le Dr Gilbert S. Omenn et Martha A. Darling Weizmann Institute – Schneider Hospital Fund for Clinical Breakthroughs through Scientific Collaborations et la Koret Foundation.
Le professeur Erez est titulaire de la Chaire Sir Ernst B. Chain.
La Chaire de Recherche de la Famille Blumberg en l’honneur de Talia Lynn Steckman soutient un chercheur du laboratoire du professeur Erez.
Neutrophiles : classe de globules blancs les plus abondants
Monocytes : produits dans la moelle osseuse et quittent la circulation sanguine pour se rendre dans la zone de l’infection


