17 Août Traiter une crise cardiaque avant qu’elle ne survienne
Une procédure préventive, réalisée sur des souris en bonne santé, a amélioré leur rétablissement à la suite d’une lésion cardiaque ultérieure, modifiant ainsi nos connaissances sur la régénération du cœur – et peut-être d’autres organes.
Imaginez qu’un jeune cœur en parfaite santé reçoive un traitement qui lui permette de se remettre, des décennies plus tard, d’une lésion qui aurait pu être dévastatrice.
Si cette perspective vous semble farfelue, vous n’êtes pas le seul. Jusqu’à récemment, le professeur Eldad Tzahor, dont le laboratoire à l’Institut Weizmann des Sciences étudie la régénération des tissus cardiaques, considérait lui aussi qu’il s’agissait de science-fiction. Après tout, les maladies cardiovasculaires, qui sont la première cause de mortalité de l’humanité, ne sont généralement pas perçues comme une chose à laquelle on peut se préparer par un traitement préventif. Mais le Prof. Tzahor et les chercheurs de son laboratoire ont maintenant activé un mécanisme cellulaire dans les cœurs de souris saines qui rend ces souris résistantes à de futures crises cardiaques, même lorsqu’elles surviennent des mois plus tard.

Prof. Eldad Tzahor
Les chercheurs soulignent que la procédure est loin d’être applicable à l’homme. Mais leurs conclusions, publiées dans Nature Cardiovascular Research, modifient notre compréhension des capacités de régénération du cœur – et peut-être d’autres organes – et de la manière dont elles pourraient être améliorées par une intervention médicale préventive.
« Il s’agit d’une preuve de concept », déclare le Prof. Tzahor, « et cela ouvre de nouvelles voies de recherche qui examinent la possibilité d’administrer un traitement cardiaque non seulement après que le dommage se soit produit, mais aussi à partir d’une position préventive qui augmente la capacité de récupération d’une lésion avant même que le dommage ne se produise ».
L’étude, dirigée par le Dr Avraham Shakked dans le laboratoire du Prof. Tzahor au Département de Biologie Cellulaire Moléculaire de Weizmann, portait sur des souris génétiquement modifiées dont les cardiomyocytes – les cellules qui constituent le tissu musculaire du cœur – surexpriment un gène qui déclenche la division cellulaire chez les souris et d’autres mammifères, y compris l’homme. Dans des études antérieures, les scientifiques du laboratoire du Prof. Tzahor avaient découvert que le gène ERBB2 provoquait la division cellulaire des cardiomyocytes, ce qui est remarquable car, à peu près au moment de la naissance, ces cellules perdent leur capacité à se multiplier.

Dr. Avraham Shakked
« Au cours du développement du fœtus, nos cellules se voient attribuer leurs différents rôles – nerfs, cornée, muscle cardiaque, etc. – par le biais d’un processus appelé différenciation », explique le Dr. Shakked. « Ce processus est caractérisé par un spectre : D’un côté, les cellules souches, qui sont indifférenciées mais capables de se diviser et de produire différents types de cellules. À l’autre extrémité, on trouve des cellules hautement spécialisées comme les cardiomyocytes, qui ne peuvent plus se diviser après s’être différenciées. Elles sont très efficaces dans leur fonction, mais le tissu qu’elles constituent ne se régénère pas naturellement ».
C’est l’une des raisons pour lesquelles les crises cardiaques sont si dévastatrices. Les crises cardiaques tuent un grand nombre de cardiomyocytes que l’organisme ne peut pas régénérer. Par conséquent, même les personnes qui survivent à l’attaque se retrouvent souvent avec des performances cardiaques réduites.
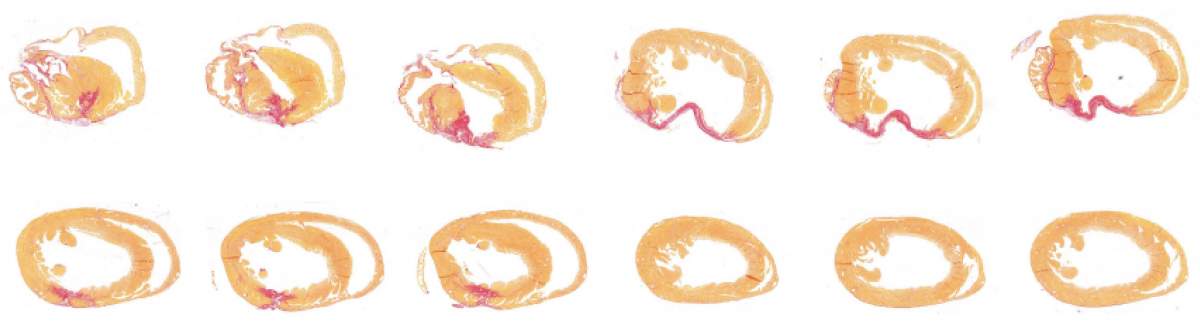
Cœurs de souris après une lésion. Le tissu cicatriciel (rouge) représente l’étendue des dommages au muscle cardiaque. Les lésions sont significativement réduites chez les souris dont le gène ERBB2 a été temporairement activé (rangée du bas), par rapport aux témoins (rangée du haut).
Lorsque, dans des études antérieures, l’équipe du Prof. Tzahor avait réussi à déclencher la division des cardiomyocytes – en activant brièvement ERBB2 dans ces cellules – la fonction cardiaque globale avait en fait diminué temporairement, au lieu de s’améliorer immédiatement. Cela s’explique par le fait que les cardiomyocytes exprimant ERBB2 ont subi une dédifférenciation, c’est-à-dire qu’ils sont revenus à un état moins spécialisé, plus proche de celui d’un cœur fœtal. Cela a limité leur capacité à se contracter, alors que cette contraction est nécessaire au bon fonctionnement du cœur. Mais une fois que la surexpression a cessé, les cardiomyocytes ont subi une redifférenciation, c’est-à-dire qu’ils sont redevenus hautement spécialisés, et les performances cardiaques se sont améliorées.
Dans cette nouvelle étude, les scientifiques ont cherché à comprendre ce qui se passe dans les cœurs « rajeunis » par ERBB2 et comment, exactement, ils se redifférencient et retrouvent une fonction normale une fois que le gène a été désactivé. Les performances de ces cœurs ne se distinguaient pas de celles du groupe témoin, mais le Dr. Shakked a remarqué des différences significatives dans l’expression des gènes entre les deux populations. « C’était surprenant et curieux », se souvient-il. « Nous avions supposé que tout revenait à la normale après la désactivation d’ERBB2 dans les cardiomyocytes. Or, nous avons observé un schéma génétique différent – surexpression de certains gènes et sous-expression d’autres – après l’activation d’ERBB2. Autrement dit, nous avons constaté des effets à long terme.
Cette découverte a amené le Dr.Shakked et le Prof. Tzahor à se demander si l’expression d’ERBB2 pouvait être calibrée pour améliorer les performances cardiaques. « Cela nous a fait penser qu’ERBB2 n’était pas seulement un interrupteur qui empêche la différenciation, mais qu’il faisait partie d’un mécanisme qui pourrait rendre le cœur plus jeune et plus résistant », explique Tzahor.
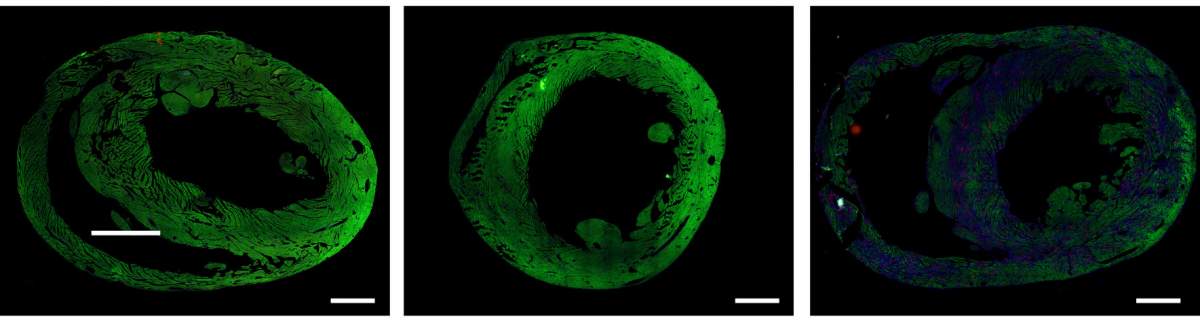
L’importance de la redifférenciation : Les protéines responsables de la contraction du muscle cardiaque (en vert) sont abondantes dans un cœur sain (à gauche) et dans un cœur dont les cellules musculaires ont subi une redifférenciation réussie après une lésion (au centre), mais pas dans un cœur dont les cellules n’ont pas subi cette redifférenciation (à droite).
Pour tester cette hypothèse, les chercheurs ont inversé l’ordre de leurs expériences précédentes avec ERBB2. Au lieu d’activer ERBB2 chez des souris blessées pour que leurs cardiomyocytes se divisent, ils l’ont d’abord activé chez des souris saines pendant quelques semaines, puis l’ont à nouveau désactivé. Ensuite, les chercheurs ont observé comment les cœurs de ces souris réagissaient à une blessure. Résultat : Les souris qui avaient été amenées à surexprimer ERBB2 se sont rétablies, mais pas les autres. « Ces données nous ont laissé pantois », se souvient le Prof. Tzahor. « Nous avions trouvé une fontaine de jouvence cardiaque chez ces souris, une nouvelle façon de rajeunir et de renforcer le cœur. »
Actuellement, l’équipe de recherche examine un certain nombre d’hypothèses sur les mécanismes par lesquels une brève surexpression d’ERBB2 pourrait aider les souris à survivre à de futures lésions cardiaques. Une possibilité est que le gène déclenche une série de changements qui permettent à davantage de cardiomyocytes de survivre au manque d’oxygène qui caractérise les crises cardiaques et qui est particulièrement destructeur pour les cardiomyocytes.
Les chercheurs ont également révélé comment une boucle de rétroaction négative entraîne la redifférenciation des cardiomyocytes. « L’organisme veille à ce que la différenciation se produise car, en général, il ne veut pas de cellules qui ne font que se diviser, comme les cellules cancéreuses », explique le Prof. Tzahor. « C’est pourquoi ERBB2, tout en poussant les cardiomyocytes dans la direction opposée à la différenciation naturelle, active simultanément les gènes qui déclenchent la différenciation. Des freins et des contrepoids sont en place. Sans ce mécanisme, les cellules cardiaques dédifférenciées n’auraient pas pu se redifférencier pour redevenir des cardiomyocytes fonctionnels », explique le Prof. Tzahor.
L’équipe a constaté qu’une souris dont l’ERBB2 avait été temporairement activée à l’âge de trois mois s’était remise d’une importante lésion cardiaque survenue cinq mois plus tard. « Si l’on transpose ce résultat à l’homme, c’est comparable à un traitement administré à une personne de 18 ans qui lui permettrait de survivre à une crise cardiaque à l’âge de 50 ans », explique le Prof. Tzahor.
Toutefois, ce type de traitement est pour l’instant loin d’être applicable aux êtres humains. « Nous diminuons la fonction des cardiomyocytes pour pouvoir les restaurer à l’avenir », explique le Prof. Tzahor. « D’un point de vue clinique, il s’agit d’une intervention extrême et radicale. Néanmoins, du moins en principe, nos recherches pourraient permettre de traiter les personnes présentant un risque élevé de crise cardiaque, avant même que celle-ci ne se produise. »
La science en chiffres
Les cardiomyocytes dépendent tellement d’un apport régulier d’oxygène que toute interruption est particulièrement dévastatrice pour eux. Une crise cardiaque, même légère, peut tuer 1 000 000 000 de cardiomyocytes, soit environ 25 % du nombre total de ces cellules dans un cœur humain moyen


