09 Mar Les mystères de la vie convergent dans une gouttelette
Recréant les conditions qui ont pu exister avant l’apparition de la vie, les chercheurs ont observé des gouttelettes qui donnent naissance aux précurseurs possibles des protéines actuelles.
Deux mystères biologiques, séparés par des milliards d’années, se sont rejoints dans un récent projet de recherche à l’Institut Weizmann des Sciences.
L’un concerne l’origine de la vie, ou plus précisément, l’origine des protéines – ces molécules biologiques essentielles à la vie. Comment de petits segments de protéines flottant dans la soupe primordiale – l’environnement humide et riche en molécules organiques qui aurait existé sur Terre il y a environ quatre milliards d’années – ont-ils évolué vers les molécules protéiques beaucoup plus grandes et complexes que nous connaissons aujourd’hui ?
 Dr. Manas Seal (g) et Prof.Daniella Goldfarb (d)
Dr. Manas Seal (g) et Prof.Daniella Goldfarb (d)
Cherchant à répondre à cette question, des scientifiques du laboratoire du défunt professeur Dan Tawfik, ainsi que des collègues, ont reconstitué mathématiquement un possible ancêtre lointain des protéines modernes. Dans leur modèle, cet ancêtre consistait en deux petits segments de protéines, ou peptides, avec des séquences d’acides aminés presque identiques – un « mot » peptidique répété deux fois pour former une « phrase » protéique simple. Cette répétition suggère que certaines des premières protéines pourraient avoir été créées par l’association de séquences élémentaires d’acides aminés.
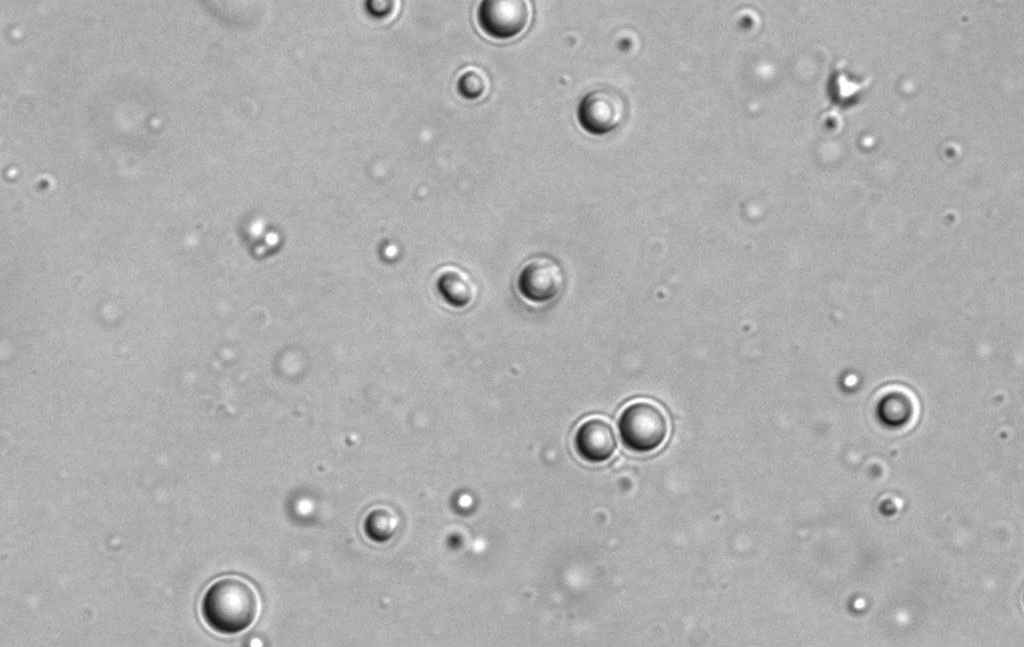
Pour reproduire ce processus en laboratoire, les scientifiques ont synthétisé leur hypothétique protéine ancestrale, l’ont coupée en deux, puis ont placé les deux « mots » peptidiques résultants dans l’eau. Ils n’ont trouvé aucun signe d’assemblage des mots en paires, mais lorsque le Dr Liam Longo, alors chercheur postdoctoral dans le laboratoire du Prof. Tawfik, a ajouté au mélange une certaine quantité d’ARN – qui aurait pu être une molécule dominante dans le monde de la pré-vie – l’eau est soudainement devenue trouble. Au microscope, le Dr. Longo a constaté que les peptides chargés positivement s’étaient condensés en gouttelettes en se combinant avec l’ARN chargé négativement.
« C’était vraiment passionnant, car les événements d’assemblage que nous recherchions pouvaient avoir lieu à l’intérieur de ces gouttelettes », explique Longo, désormais chercheur principal à l’Institut de technologie de Tokyo.

De minuscules gouttelettes formées par des peptides et de l’ARN, observées au microscope.
En fait, il y a un peu plus de dix ans, des scientifiques avaient découvert que des gouttelettes similaires étaient naturellement présentes à l’intérieur des cellules. Ces constructions fascinantes sont des assemblages liquides de protéines seules, ou de protéines avec de l’ARN ou de l’ADN ; elles se forment un peu comme des gouttes d’huile dans l’eau, par séparation de phase entre deux liquides. À l’intérieur des gouttelettes, les protéines peuvent atteindre des concentrations des centaines de fois supérieures à ce qu’elles sont à l’extérieur. En 2018, le magazine Science a désigné les gouttelettes comme la percée de l’année, évoquant l’étude de ces gouttelettes comme « l’un des sujets les plus chauds de la biologie cellulaire. » Pourtant, on ignore encore beaucoup de choses sur les mécanismes de formation de ces gouttelettes et sur les objectifs qu’elles poursuivent dans les cellules – par exemple, pourraient-elles être utilisées pour le stockage ou pour remplir des fonctions de régulation.
C’est là que les deux mystères biologiques convergent. Le Prof. Tawfik, du Département des Sciences Biomoléculaires de Weizmann, a entrepris l’étude des gouttelettes peptide-ARN pour voir si elles pouvaient avoir joué un rôle dans l’origine des protéines, mais il était clair que cette recherche pouvait également jeter un nouvel éclairage sur les rôles que des gouttelettes similaires jouent aujourd’hui dans le corps humain.
La chasse au dimère
Le Prof. Tawfik et ses collègues ont émis l’hypothèse que dans le monde pré-vivant, les gouttelettes de peptides et d’ARN formées dans la soupe primordiale ont pu servir de protocellules, précurseurs des cellules vivantes modernes. Les gouttelettes auraient créé une sorte de compartiment, rapprochant les peptides de leur isolement dans la vaste soupe diluée, leur permettant ainsi de s’auto-assembler en structures doubles appelées dimères : des paires de molécules peptidiques attirées les unes vers les autres par des forces moléculaires. Un dimère pourrait ensuite fusionner en une seule molécule, créant ainsi une protéine ancestrale à deux mots semblable à celle reconstituée par les scientifiques.
Cependant, il était difficile de prouver l’existence de ces dimères, car ils ne pouvaient pas être détectés par les méthodes standard de résolution de structures qui s’appliquent aux solutions : La résolution fournie par ces méthodes est trop faible pour cette tâche. Pour surmonter cet obstacle, le Prof. Tawfik et ses collègues se sont associés au professeur Daniella Goldfarb du Département de Physique Chimique et Biologique de Weizmann, qui étudie la structure et la dynamique des protéines au moyen de la résonance paramagnétique électronique. « Cette collaboration est née de mon amitié avec Danny », se souvient Goldfarb. « Il m’a dit qu’il avait une hypothèse sur l’évolution des protéines complexes à partir de peptides primordiaux, et j’ai suggéré de tester cette idée expérimentalement, en utilisant l’expertise de mon laboratoire. »
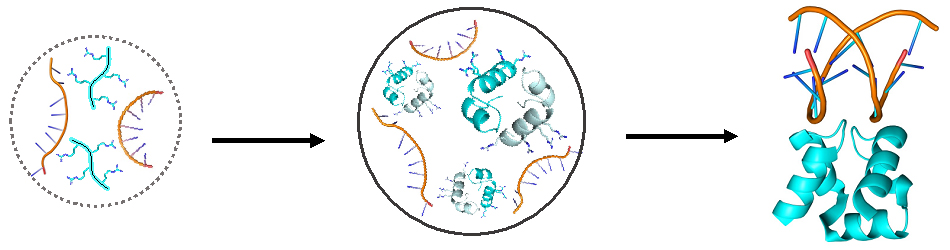
Proposition d’évolution des protéines anciennes : des peptides individuels flottant librement sans structure (turquoise, à gauche) à une protéine ancestrale fusionnée et structurée liant l’ADN (turquoise, à droite) via une étape intermédiaire – peptides assemblés en dimères à l’intérieur de gouttelettes (au milieu).
Le Prof. Goldfarb et ses collègues ont entrepris de rechercher les dimères proposés par le Prof.Tawfik en marquant les peptides avec des marqueurs de spin, de minuscules molécules aux propriétés magnétiques particulières, préparées dans le laboratoire du professeur Norman Metanis à l’Université hébraïque de Jérusalem. Lorsque les peptides marqués sont ensuite placés dans un champ magnétique, les étiquettes peuvent agir comme des espions qui rendent compte des propriétés du peptide auquel elles sont attachées. Ainsi, lorsque les scientifiques ont réalisé une expérience appelée double résonance électron-électron, dans laquelle ils ont appliqué une série d’impulsions micro-ondes à une solution contenant des peptides, ils ont pu déterminer la distance entre les peptides en détectant certaines interactions magnétiques entre les étiquettes. Si les interactions révèlent que deux peptides sont très proches, cela signifie qu’ils ont formé un dimère. Mais l’optimisation des conditions expérimentales s’est avérée délicate, et les premières mesures n’ont pas permis de repérer de dimères dans une solution de peptides, avec ou sans ARN.
La tragédie et le triomphe
Au milieu de la recherche, la tragédie a frappé. Le 4 mai 2021, le Prof. Tawfik fait une chute mortelle dans un accident d’escalade.
Avec un timing étonnant, le lendemain, le Dr Manas Seal, un stagiaire postdoctoral du laboratoire du Prof. Goldfarb, a réussi à trouver des dimères dans une solution peptidique.
« Cela me brise le cœur que Danny n’ait jamais pu voir ce résultat », dit le Dr. Longo. « Il voulait tellement voir ces dimères ».

Feu le professeur Dan Tawfik. À la recherche de l’origine de la vie
Les scientifiques ont poursuivi leurs expériences pour voir si les peptides forment également des dimères lorsqu’ils sont liés à l’ARN dans les gouttelettes. Les chercheurs ont d’abord prouvé que les peptides se lient effectivement à l’ARN dans les gouttelettes : Ils l’ont confirmé en détectant un ralentissement du mouvement de leurs espions. Ensuite, ils ont entrepris de retracer les interactions magnétiques entre les espions. L’interprétation des signaux magnétiques obtenus à partir de gouttelettes très denses s’est toutefois avérée extrêmement difficile. Les scientifiques ont analysé une grande variété de rapports différents d’ARN et de peptides jusqu’à ce qu’ils parviennent à prouver l’existence des dimères au sein des gouttelettes.
« Nous avons constaté que la liaison à l’ARN favorise en fait la formation des dimères », explique le Dr. Seal, qui a dirigé ces expériences. « Cette liaison aide probablement les peptides à se retrouver, tout comme deux personnes séparées par une grande distance pourraient se retrouver plus facilement si elles s’accrochent à la même corde ».

Dr Liam Longo
Les résultats de l’étude suggèrent que, dans un passé lointain, les gouttelettes ont pu servir de creuset à une étape critique de l’évolution des protéines. Elles auraient rendu possible la transition entre les peptides courts et les protéines plus longues qui se replient en structures complexes leur permettant de remplir des fonctions biologiques. L’une des premières fonctions de ce type – celle observée dans la protéine ancestrale reconstituée par le Prof. Tawfik et ses collègues – était de se lier à des acides nucléiques, comme l’ARN ou l’ADN, une première étape nécessaire pour favoriser l’expression du code génétique. Dans notre article, nous parlons des gouttelettes comme d’un « berceau » pour l’évolution des protéines repliées », explique le Dr. Longo.
Les protéines présentes dans les gouttelettes à l’intérieur de nos cellules peuvent atteindre des concentrations de 3 à 15 micromoles, soit des centaines de fois
plus élevées que dans le cytoplasme.
Ces connaissances pourraient également s’avérer utiles pour comprendre ce qui se passe à l’intérieur des gouttelettes qui participent à divers processus cellulaires fondamentaux, tant dans le corps humain sain que malade. Par exemple, on pense que des défauts dans les mécanismes de formation des gouttelettes contribuent aux maladies neurodégénératives ; une connaissance approfondie de ces mécanismes, et de la manière dont ils affectent la structure des protéines, pourrait déboucher sur de nouvelles méthodes de diagnostic et de nouveaux traitements.


